题目内容
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、在25℃,1.01×105Pa时,11.2L氮气所含的原子数目为NA |
| B、48g O3 和O2混合气体所含的原子数目为3NA |
| C、1mol氦气所含的电子数目为4NA |
| D、2.7g金属铝变成铝离子时失去的电子数目为0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、标准状况下,气体摩尔体积为22.4L/mol;
B、O2、O3都是由氧元素组成,48g为氧原子质量,根据n=
计算氧原子物质的量,再根据N=nNA计算氧原子数目;
C、稀有气体是单原子分子,再根据N=nNA计算氦原子数目;
D、铝原子失去3个电子形成铝离子,根据n=
计算铝的物质的量,再根据N=nNA计算失去电子数.
B、O2、O3都是由氧元素组成,48g为氧原子质量,根据n=
| m |
| M |
C、稀有气体是单原子分子,再根据N=nNA计算氦原子数目;
D、铝原子失去3个电子形成铝离子,根据n=
| m |
| M |
解答:
解:A、不是标准状况,不能使用气体摩尔体积22.4L/mol,故B错误;
B、O2、O3都是由氧元素组成,48g为氧原子质量,氧原子物质的量为
=3mol,含有的氧原子数目为3mol×NAmol-1=3NA,故B正确;
C、氦气是单原子分子,故所含的氦原子数目为1mol×1×NAmol-1=NA,故C错误;
D、2.7g金属铝变成铝离子时失去的电子数目为
×3×NAmol-1=0.3NA,故D错误;
故选B.
B、O2、O3都是由氧元素组成,48g为氧原子质量,氧原子物质的量为
| 48g |
| 16g/mol |
C、氦气是单原子分子,故所含的氦原子数目为1mol×1×NAmol-1=NA,故C错误;
D、2.7g金属铝变成铝离子时失去的电子数目为
| 27g |
| 27g/mol |
故选B.
点评:本题考查常用化学计量数的有关计算,注意稀有气体是单原子分子,气体摩尔体积的使用条件范围.

练习册系列答案
相关题目
下列离子中外层d轨道达半充满状态的是( )
| A、Cr3+ |
| B、Cu+ |
| C、Co3+ |
| D、Fe3+ |
某原子的最外层电子排布为nsnnp2n+1,则该元素在周期表中的位置为( )
| A、第二周期,ⅢA族 |
| B、第二周期,ⅦA族 |
| C、第五周期,ⅡA族 |
| D、第七周期,ⅡA族 |
 钙、铝、铜都是中学化学中常见的金属元素.
钙、铝、铜都是中学化学中常见的金属元素.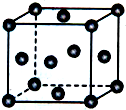 已知X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时2p轨道上的未成对电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为[Ar]3d9.
已知X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时2p轨道上的未成对电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为[Ar]3d9.