题目内容
下列实验方案可行的是( )
A、检验溶液中是否有SO
| ||
| B、检验溶液中是否有K+时,用灼烧过的铂丝蘸取试液,观察焰色是否呈紫色 | ||
C、检验溶液中是否有NO
| ||
D、检验溶液中是否含有CO
|
考点:物质的检验和鉴别的实验方案设计
专题:实验评价题
分析:A、检验溶液中加入BaCl2溶液后加稀硝酸,根据沉淀是否消失检验硫酸根离子不能排除SO32-和Ag+的干扰;
B、钾离子检验时,焰色反应必须通过钴玻璃来观察;
C、亚硝酸根离子的检验利用的是其对应的还原产物是红棕色的二氧化氮来检验;
D、能使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫.
B、钾离子检验时,焰色反应必须通过钴玻璃来观察;
C、亚硝酸根离子的检验利用的是其对应的还原产物是红棕色的二氧化氮来检验;
D、能使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫.
解答:
解:A、检验溶液中加入BaCl2溶液后加稀硝酸,如果含有SO32-,也能被硝酸氧化为SO42-,并且不能排除Ag+的干扰,故A错误;
B、将铂丝放在稀盐酸中洗涤后灼烧至无色,然后用铂丝蘸取待测液置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察为紫色,可检验钾元素,故B错误;
C、先加AgNO3,再加稀硝酸,若沉淀消失,有红棕色气体生成,可以证明亚硝酸根离子的存在,故C正确;
D、能使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫,所以向某溶液中加入稀HCl,放出能使澄清的石灰水变浑浊的气体,原溶液中不一定有碳酸根离子,可能有碳酸根离子、碳酸氢根离子、亚硫酸根离子、亚硫酸氢根离子中的一种或几种,故D错误;
故选C.
B、将铂丝放在稀盐酸中洗涤后灼烧至无色,然后用铂丝蘸取待测液置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察为紫色,可检验钾元素,故B错误;
C、先加AgNO3,再加稀硝酸,若沉淀消失,有红棕色气体生成,可以证明亚硝酸根离子的存在,故C正确;
D、能使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫,所以向某溶液中加入稀HCl,放出能使澄清的石灰水变浑浊的气体,原溶液中不一定有碳酸根离子,可能有碳酸根离子、碳酸氢根离子、亚硫酸根离子、亚硫酸氢根离子中的一种或几种,故D错误;
故选C.
点评:本题考查物质检验和鉴别的实验方案设计,为高频考点,涉及离子检验、焰色反应等,把握常见离子的性质及检验方法、检验试剂及现象与结论的关系为解答的关键,题目难度中等.

练习册系列答案
相关题目
下列有关化学用语错误的是( )
A、Na+的基态电子排布图是: |
B、H2O分子的电子式为: |
| C、Ca2+离子基态电子排布式为:1s22s22p63s23p6 |
D、氯原子结构示意图为: |
已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ?mol-1
2CO(g)═2C(s)+O2(g)△H=+221kJ?mol-1
则反应TiO2(s)+2Cl2(g)+2C(s)═TiCl4(l)+2CO(g)△H为( )
2CO(g)═2C(s)+O2(g)△H=+221kJ?mol-1
则反应TiO2(s)+2Cl2(g)+2C(s)═TiCl4(l)+2CO(g)△H为( )
| A、-162 kJ?mol-1 |
| B、+81 kJ?mol-1 |
| C、+162 kJ?mol-1 |
| D、-81 kJ?mol-1 |
已知X、Y是主族元素,I为电离能,单位是kJ?mol-1.请根据下表所列数据判断,错误的是( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 502 | 4 600 | 6 900 | 9 500 |
| Y | 588 | 1 820 | 2 750 | 11 600 |
| A、元素X的常见化合价是+1 |
| B、若元素Y处于第3周期,它可与冷水剧烈反应 |
| C、元素Y是ⅢA族元素 |
| D、元素X与氯形成化合物时,化学式可能是XCl |
 钙、铝、铜都是中学化学中常见的金属元素.
钙、铝、铜都是中学化学中常见的金属元素.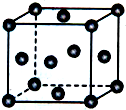 已知X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时2p轨道上的未成对电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为[Ar]3d9.
已知X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时2p轨道上的未成对电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为[Ar]3d9.