题目内容
11.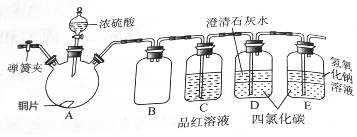 某研究性学习小组为研究Cu与浓硫酸的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出).
某研究性学习小组为研究Cu与浓硫酸的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出).实验选用铜片、98.3%的H2SO4溶液、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜片一端伸人浓硫酸中,另一端露置在液面上方.
回答下列问题.
(1)Cu与浓硫酸反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)D、E两容器中CCl4的作用是防止倒吸.
分析 (1)浓硫酸和Cu共热反应生成硫酸铜、二氧化硫、水,依此写出化学方程式;
(2)二氧化硫和强碱的反应十分剧烈,要注意防止倒吸现象的发生.
解答 解:(1)浓硫酸和Cu共热反应生成硫酸铜、二氧化硫、水,化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)二氧化硫和强碱的反应十分剧烈,可以采用四氯化碳的作用来达到防止倒吸现象的发生的目的,
故答案为:防止倒吸.
点评 本题考查了浓硫酸的性质,题目难度中等,注意掌握浓硫酸具有的化学性质,明确性质实验方案设计的方法,明确题中资料信息是解题根据,试题培养了学生的分析、理解能力.

练习册系列答案
相关题目
4.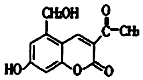 某种利胆解痉药的有效成分是亮菌甲素,其结构简式如图所示.下列关于亮菌甲素的说法中,正确的是( )
某种利胆解痉药的有效成分是亮菌甲素,其结构简式如图所示.下列关于亮菌甲素的说法中,正确的是( )
 某种利胆解痉药的有效成分是亮菌甲素,其结构简式如图所示.下列关于亮菌甲素的说法中,正确的是( )
某种利胆解痉药的有效成分是亮菌甲素,其结构简式如图所示.下列关于亮菌甲素的说法中,正确的是( )| A. | 亮菌甲素的分子式为C12H12O5 | |
| B. | 1mol亮菌甲素最多能和2molNaOH反应 | |
| C. | 1mol亮菌甲素最多能和4 molH2发生加成反应 | |
| D. | 亮菌甲素在一定条件下可以与乙酸发生酯化反应 |
4.设NA为阿伏伽德罗常数.下列叙述中正确的是( )
| A. | 0.25mol Na2O2中含有的阴离子数为0.5NA | |
| B. | 等物质的量的OH-与烃基(-OH)所含电子数相等 | |
| C. | 惰性电极电解食盐水,若电路中通过NA个电子,则标况下阳极产生气体11.2L | |
| D. | 25℃时,pH=13的1.0LBa(OH)2溶液中含OH-数目为0.2NA |
19.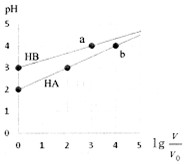 室温下,浓度均为0.1mol•L-1、体积均为V0HA、HB溶液,分别加水稀释至V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列说法正确的是( )
室温下,浓度均为0.1mol•L-1、体积均为V0HA、HB溶液,分别加水稀释至V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列说法正确的是( )
 室温下,浓度均为0.1mol•L-1、体积均为V0HA、HB溶液,分别加水稀释至V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列说法正确的是( )
室温下,浓度均为0.1mol•L-1、体积均为V0HA、HB溶液,分别加水稀释至V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列说法正确的是( )| A. | HA为强酸,HB为弱酸 | |
| B. | 水的电离程度a点大于b点 | |
| C. | 当pH=2时,HA溶液中$\frac{c(HA)}{c({A}^{-})}$=9 | |
| D. | 等浓度等体积的HB与Na0H溶液充分反应后,离子浓度关系大小为:c(B-)>c(Na+)>c(H+)>c(OH-) |
6.用NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )
| A. | 22.4L氯气与足量镁粉充分反应后,转移的电子数为2NA | |
| B. | 常温下,1L0.5mo1•L-1 FeCl3溶液中含有的Fe3+数目一定小于0.5NA | |
| C. | 12g石墨中含有C-C共价键数为1.5NA | |
| D. | 28g由乙烯和环丁烷(C4H8)组成的混合气体中含有的碳原子数为2NA |
16.NA表示阿伏伽德罗常数的值,下列叙述不正确的是( )
| A. | 60g SiO2晶体含4NA个σ键 | |
| B. | 1mol[Cu(NH3)4]2+中含4NA配位键 | |
| C. | 在24g石墨中,含C-C共价键数目为6NA | |
| D. | CO和N2是等电子体,标况下22.4L的CO气体与1mol N2所含的电子数相等 |
3.根据下列结构示意图,判断下列说法中正确的是( )

| A. | 在NaCl晶体中,距Na+最近的多个Cl-构成正四面体 | |
| B. | 在CaF2晶体中,每个晶胞平均占有4个Ca2+ | |
| C. | 在金刚石晶体中,碳原子与碳碳键数之比为1:2 | |
| D. | 该气态团簇分子的分子式为EH或HE |