题目内容
4.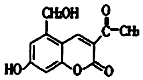 某种利胆解痉药的有效成分是亮菌甲素,其结构简式如图所示.下列关于亮菌甲素的说法中,正确的是( )
某种利胆解痉药的有效成分是亮菌甲素,其结构简式如图所示.下列关于亮菌甲素的说法中,正确的是( )| A. | 亮菌甲素的分子式为C12H12O5 | |
| B. | 1mol亮菌甲素最多能和2molNaOH反应 | |
| C. | 1mol亮菌甲素最多能和4 molH2发生加成反应 | |
| D. | 亮菌甲素在一定条件下可以与乙酸发生酯化反应 |
分析 由结构可知,分子中含酚-OH、醇-OH、碳碳双键、-COOC-及羰基,结合酚、醇、烯烃、酯及酮的性质来解答.
解答 解:A.“亮菌甲素”分子中含有12个C原子、10个H原子、5个O原子,分子式为C12H10O5,故A错误;
B.酚羟基能与氢氧化钠反应,水解得到羧基、酚羟基与氢氧化钠反应,则1 mol“亮菌甲素”最多能和3 mol NaOH反应,故B错误;
C.苯环、碳碳双键、羰基能与氢气发生加成反应,1mol“亮菌甲素”最多能和5mol H2发生加成反应,故C错误;
D.含-OH,可以与乙酸发生酯化反应,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意醇、酚、烯烃的性质,题目难度不大.

练习册系列答案
相关题目
13.今年4月22日是第48个世界地球日,我国确定的活动主题为“节约集约利用资源,倡导绿色简约生活--讲好我们的地球故事”.下列行为不符合这一活动主题的是( )
| A. | 推广使用清洁能源 | B. | 大力发展燃煤发电 | ||
| C. | 循环高效利用费源 | D. | 倡导环保低碳生活 |
14.已知反应2X(g)+Y(g)?2Z(g)△H的能量变化如图所示,下列分析正确的是( )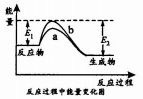

| A. | △H=+|E1-E2| | |
| B. | 曲线a为催化剂时的反应 | |
| C. | X(g)的能量高于Z(g)的能量 | |
| D. | 反应物吸收的总能量大于生成物释放的总能量 |
12.下列反应中,氧元素被还原的是( )
| A. | 2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2 | B. | Na2O+H2O═2NaOH | ||
| C. | 2F2+2H2O═4HF+O2 | D. | 2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si |
9.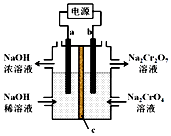 根据反应2CrO42-+2H+?Cr2O72-+H2O 用惰性电极电解Na2CrO4溶液制取Na2Cr2O7,下列说法不正确的是( )
根据反应2CrO42-+2H+?Cr2O72-+H2O 用惰性电极电解Na2CrO4溶液制取Na2Cr2O7,下列说法不正确的是( )
 根据反应2CrO42-+2H+?Cr2O72-+H2O 用惰性电极电解Na2CrO4溶液制取Na2Cr2O7,下列说法不正确的是( )
根据反应2CrO42-+2H+?Cr2O72-+H2O 用惰性电极电解Na2CrO4溶液制取Na2Cr2O7,下列说法不正确的是( )| A. | a连接电源负极 | |
| B. | b极反应式:2H2O-4e-=O2↑+4H+ | |
| C. | c为阳离子交换膜 | |
| D. | 通过2 mol电子时生成1 mol Cr2O72- |
16.提出杂化轨道理论的科学家是( )
| A. | 泡利 | B. | 洪特 | C. | J•K罗林 | D. | 鲍林 |
12.某化工厂产生含CN-浓度较高的废水,通过电解法 (以石墨为阳极,铁为阴极并加入少量NaCl进行电解)处理可大大降低废水中CN-含量.下列说法中正确的是( )
| A. | 该废水中可能含有较多的Fe2+、Fe3+ | |
| B. | 此电解法缺点之一是会产生少量氯气 | |
| C. | 阳极反应式为2CN--10e-+3H2O=CO2↑+N2↑+6H+ | |
| D. | 电解法处理后的废水pH减小 |
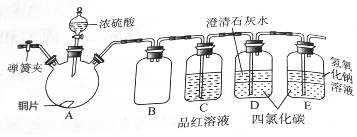 某研究性学习小组为研究Cu与浓硫酸的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出).
某研究性学习小组为研究Cu与浓硫酸的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出).