题目内容
3.根据下列结构示意图,判断下列说法中正确的是( )
| A. | 在NaCl晶体中,距Na+最近的多个Cl-构成正四面体 | |
| B. | 在CaF2晶体中,每个晶胞平均占有4个Ca2+ | |
| C. | 在金刚石晶体中,碳原子与碳碳键数之比为1:2 | |
| D. | 该气态团簇分子的分子式为EH或HE |
分析 A、根据在NaCl晶体中,距Na+最近的Cl-有6个进行分析;
B、Ca2+位于晶胞的顶点和面心,利用均摊法计算;
C、根据用均摊法分析;
D、注意气态团簇分子与晶胞的区别.
解答 解:A、在NaCl晶体中,距Na+最近的Cl-有6个,而每个Na+离子为8个晶胞共有,则距Na+最近的多个Cl-构成正八面体,故A错误;
B、Ca2+位于晶胞的顶点和面心,晶胞中含有Ca2+的个数为:$8×\frac{1}{8}$+$6×\frac{1}{2}$=4,故B正确;
C、在金刚石晶体中,每个碳原子形成4个共价键,每两个碳原子形成一个共价键,则每个碳原子形成的共价键平均为$4×\frac{1}{2}$=2,所以在金刚石晶体中,碳原子与碳碳键数之比为1:2,故C正确;
D、气态团簇分子不同于晶胞,气态团簇分子中含有4个E原子,4个F原子,则分子式为E4H4或H4E4,故D错误.
故选BC.
点评 本题考查晶胞的计算,题目难度较大,本题尤其注意气态团簇分子与晶胞的区别,为本题的易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.提出杂化轨道理论的科学家是( )
| A. | 泡利 | B. | 洪特 | C. | J•K罗林 | D. | 鲍林 |
15.X、Y、Z、R是短周期主族元素,X元素是形成有机化合物的必需元素,Y元素的原子最外层电子数是次外层的三倍,Z元素的原子半径是短周期元素中最大的,R原子的核外电子数是X原子核Z原子的核外电子数之和.下列叙述不正确的是( )
| A. | XY2是形成酸雨的主要污染物 | |
| B. | X、Y、R三种元素的非金属性Y>R>X | |
| C. | X、Z分别与R形成的化合物中化学键类型不同 | |
| D. | 含有Y、Z、R三种元素的化合物溶液可能显碱性 |
18.化学反应原理是工业合成氨的重要理论基础.
(1)合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,若在恒温、恒压条件下向平衡体系中通入氩气,平衡向左移动(填“向左”、“向右”或“不”);使用催化剂该反应的△H不变(填“增大”、“减小”或“不变”).
(2)在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
下列说法正确的是BD(填字母编号).
A.2c1>c3 B.a+b=92.4 C.2p2<p3 D.a1+a3<1
(3)合成氨在等容条件下进行.改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图1所示:

①N2的平均反应速率vI(N2)、vII(N2)、vIII(N2)从大到小排列次序为vI(N2)>vII(N2)>vIII(N2).
②由第一次平衡到第二次平衡,平衡移动的方向是正向移动,采取的措施是降低了生成物浓度或分离出NH3.
③比较第II阶段反应温度(T2)和第III阶段反应温度(T3)的高低:T2>T3(填“>”、“=”或“<”),判断的理由是此反应为放热反应,降低温度,平衡向正反应方向移动,平衡的移动只能减弱改变,不能抵消改变.
(4)将0.1mol N2和0.3mol H2通入一容积可变的容器中进行工业固氮反应.
①若300℃、压强P2时达到平衡,容器容积恰为10L,则此状态下反应的平衡常数K=22.6(mol•L-1)-2(计算结果保留3位有效数字).
②合成氨反应达到平衡后,t1时刻速率发生如图B变化,此刻可能改变的反应条件是加压或缩小容器体积或增大反应物浓度(回答一种).
(1)合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,若在恒温、恒压条件下向平衡体系中通入氩气,平衡向左移动(填“向左”、“向右”或“不”);使用催化剂该反应的△H不变(填“增大”、“减小”或“不变”).
(2)在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| 平衡时NH3的浓度(mol•L-1) | cl | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收bkJ | 吸收c kj |
| 体系压强(pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
A.2c1>c3 B.a+b=92.4 C.2p2<p3 D.a1+a3<1
(3)合成氨在等容条件下进行.改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图1所示:

①N2的平均反应速率vI(N2)、vII(N2)、vIII(N2)从大到小排列次序为vI(N2)>vII(N2)>vIII(N2).
②由第一次平衡到第二次平衡,平衡移动的方向是正向移动,采取的措施是降低了生成物浓度或分离出NH3.
③比较第II阶段反应温度(T2)和第III阶段反应温度(T3)的高低:T2>T3(填“>”、“=”或“<”),判断的理由是此反应为放热反应,降低温度,平衡向正反应方向移动,平衡的移动只能减弱改变,不能抵消改变.
(4)将0.1mol N2和0.3mol H2通入一容积可变的容器中进行工业固氮反应.
①若300℃、压强P2时达到平衡,容器容积恰为10L,则此状态下反应的平衡常数K=22.6(mol•L-1)-2(计算结果保留3位有效数字).
②合成氨反应达到平衡后,t1时刻速率发生如图B变化,此刻可能改变的反应条件是加压或缩小容器体积或增大反应物浓度(回答一种).
8.常温下,将0.1L0.2mol/LKMnO4酸性溶液与一定量pH=3的草酸(HOOC-COOH)溶液混合,放出VL气体.NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | pH=3的草酸溶液含有H+数目为0.001NA | |
| B. | 当1molKMnO4被还原时强酸提供H+数目为NA | |
| C. | 1molHOOC-COOH含共用电子对数目为9NA | |
| D. | 该反应释放CO2分子数目为$\frac{V}{22.4}$NA |
15.W、X、Y、Z均为前三周期元素,W原子种只有质子,没有中子;X原子最外层电子数与次外层电子数相等;Y是短周期主族元素中原子半径最大的元素;Z元素的单质是空气的主要成分之一,且Z元素的单质与Y元素的单质在不同条件下可生成两种不同原子个数比的化合物.下列说法正确的是( )
| A. | W元素无同位素 | |
| B. | X单质分子中含共价键 | |
| C. | 简单离子半径:Y<Z | |
| D. | W、Y、Z不能存在于同一离子化合物中 |
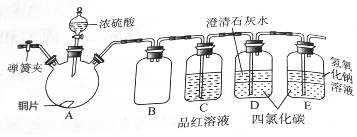 某研究性学习小组为研究Cu与浓硫酸的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出).
某研究性学习小组为研究Cu与浓硫酸的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出).