题目内容
研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义。
(1)下列措施中,有利于降低大气中的CO2、SO2、NO2浓度的有___________(填字母)。
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
(2)为开发新能源,有关部门拟用甲醇(CH3OH)替代汽油作为公交车的燃料。写出由CO和H2生产甲醇的化学方程式________________________,
用该反应合成1 mol液态甲醇吸收热量131.9 kJ。又知2H2(g)+CO(g)+3/2O2(g)==CO2(g)+2H2O(g) ΔH=-594.1 kJ/mol。请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式_________________。
练习册系列答案
相关题目
12.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”,进行了如下实验:
请回答:
(1)已知KMnO4酸性溶液与H2C2O4溶液反应有CO2生成,用化学方程式表示该实验的实验原理:2KMnO4+5H2C2O4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O.
(2)根据表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度,反应速率增大.
(3)利用实验3中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=1.5×10-2mol/(L•min).
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示.

该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
③若该小组同学提出的假设成立,应观察到的现象是与实验1比较,溶液褪色所需时间短(或所用时间(t)小于4min).
| 实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L稀硫酸 | ||
| 1 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
(1)已知KMnO4酸性溶液与H2C2O4溶液反应有CO2生成,用化学方程式表示该实验的实验原理:2KMnO4+5H2C2O4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O.
(2)根据表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度,反应速率增大.
(3)利用实验3中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=1.5×10-2mol/(L•min).
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示.

该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |


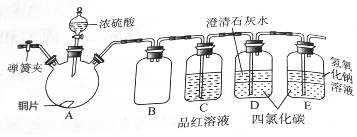 某研究性学习小组为研究Cu与浓硫酸的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出).
某研究性学习小组为研究Cu与浓硫酸的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出). 2NO+O2在恒容的密闭容器中进行,达到平衡状态的标志是( )
2NO+O2在恒容的密闭容器中进行,达到平衡状态的标志是( )
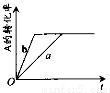
 3C(g) + D(s) △H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程。若使a曲线变为b曲线,可能采取的措施是
3C(g) + D(s) △H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程。若使a曲线变为b曲线,可能采取的措施是