题目内容
4.设NA为阿伏伽德罗常数.下列叙述中正确的是( )| A. | 0.25mol Na2O2中含有的阴离子数为0.5NA | |
| B. | 等物质的量的OH-与烃基(-OH)所含电子数相等 | |
| C. | 惰性电极电解食盐水,若电路中通过NA个电子,则标况下阳极产生气体11.2L | |
| D. | 25℃时,pH=13的1.0LBa(OH)2溶液中含OH-数目为0.2NA |
分析 A.过氧化钠中的阴离子为过氧根离子,0.25mol过氧化钠中含有0.25mol阴离子;
B.羟基和氢氧根离子分别含有电子数为9、10;
C.阳极生成的是氯气,根据电子守恒计算;
D.pH=13的溶液中氢氧根离子浓度为0.1mol/L,根据n=cV=$\frac{N}{{N}_{A}}$计算.
解答 解:A.0.25mol Na2O2中含有0.25mol过氧根离子,则含有阴离子数为0.25NA,故A错误;
B.羟基含有9个电子,氢氧根离子含有10个电子,物质的量相等时二者含有的电子数不相等,故B错误;
C.惰性电极电解食盐水,若电路中通过NA个电子,即1mol电子,阳极生成的为氯气,根据电子守恒可知生成氯气的物质的量为:$\frac{1mol}{2}$=0.5mol,标况下0.5mol氯气的体积为11.2L,即标况下阳极产生气体11.2L,故C正确;
D.25℃时,pH=13的1.0LBa(OH)2溶液中氢氧根离子浓度为0.1mol/L,1L该溶液中含有0.1mol氢氧根离子,则含OH-数目为0.1NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确氢键与氢氧根离子的区别,为易错点,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
14.已知反应2X(g)+Y(g)?2Z(g)△H的能量变化如图所示,下列分析正确的是( )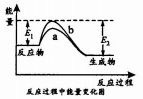

| A. | △H=+|E1-E2| | |
| B. | 曲线a为催化剂时的反应 | |
| C. | X(g)的能量高于Z(g)的能量 | |
| D. | 反应物吸收的总能量大于生成物释放的总能量 |
16.提出杂化轨道理论的科学家是( )
| A. | 泡利 | B. | 洪特 | C. | J•K罗林 | D. | 鲍林 |
12.某化工厂产生含CN-浓度较高的废水,通过电解法 (以石墨为阳极,铁为阴极并加入少量NaCl进行电解)处理可大大降低废水中CN-含量.下列说法中正确的是( )
| A. | 该废水中可能含有较多的Fe2+、Fe3+ | |
| B. | 此电解法缺点之一是会产生少量氯气 | |
| C. | 阳极反应式为2CN--10e-+3H2O=CO2↑+N2↑+6H+ | |
| D. | 电解法处理后的废水pH减小 |
19.设NA为阿伏加徳罗常数的值,下列说法不正确的是( )
| A. | 9.2gNO2和N2O4的混合物中含氮原子数目为0.2NA | |
| B. | 常温常压下,35.5g Cl2与足量的NaOH溶液完全反应,转移的电子数为0.5NA | |
| C. | 标准状况下,2.24LNH3与1.6gCH4分子中所含电子数目均为NA | |
| D. | 已知反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,当生成NA个NH3分子时,反应放出的热量小于46.2kJ |
8.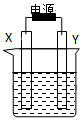 如图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生.一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中正确的是( )
如图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生.一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中正确的是( )
 如图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生.一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中正确的是( )
如图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生.一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中正确的是( )| A. | X电极连接电源正极 | B. | 生成气体体积为0.56L | ||
| C. | Y电极上发生氧化反应 | D. | 该CuCl2溶液浓度为0.05mol/L |
15.X、Y、Z、R是短周期主族元素,X元素是形成有机化合物的必需元素,Y元素的原子最外层电子数是次外层的三倍,Z元素的原子半径是短周期元素中最大的,R原子的核外电子数是X原子核Z原子的核外电子数之和.下列叙述不正确的是( )
| A. | XY2是形成酸雨的主要污染物 | |
| B. | X、Y、R三种元素的非金属性Y>R>X | |
| C. | X、Z分别与R形成的化合物中化学键类型不同 | |
| D. | 含有Y、Z、R三种元素的化合物溶液可能显碱性 |
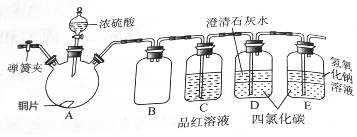 某研究性学习小组为研究Cu与浓硫酸的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出).
某研究性学习小组为研究Cu与浓硫酸的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出).