题目内容
6.用NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )| A. | 22.4L氯气与足量镁粉充分反应后,转移的电子数为2NA | |
| B. | 常温下,1L0.5mo1•L-1 FeCl3溶液中含有的Fe3+数目一定小于0.5NA | |
| C. | 12g石墨中含有C-C共价键数为1.5NA | |
| D. | 28g由乙烯和环丁烷(C4H8)组成的混合气体中含有的碳原子数为2NA |
分析 A.没有告诉在标况下,不能使用标况下气体摩尔体积计算;
B.铁离子部分水解,导致铁离子数目减少;
C.根据石墨晶体中一个C与其它三个碳原子形成3个共价键,采用均摊法计算出含有的碳碳键数目;
D.乙烯和环丁烷的最简式均为CH2,根据最简式计算.
解答 解:A.不是标况下,不能使用标况下的气体摩尔体积计算氯气的物质的量,故A错误;
B.常温下,1L0.5mo1•L-1 FeCl3溶液中含有0.5mol氯化铁,由于铁离子部分水解,则溶液中含有的Fe3+数目一定小于0.5NA,故B正确;
C.12g石墨含有的碳原子的物质的量为1mol,每个碳原子与其它碳原子形成了3个碳碳键,每个碳原子形成的共价键为:$\frac{1}{2}$×3=1.5个,所以1molC形成了1.5mol共价键,含C-C共价键数目为1.5NA,故C正确;
D.乙烯和环丁烷的最简式均为CH2,则28g混合物中含2molCH2,含2NA个碳原子,故D正确;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,明确标况下气体摩尔体积的使用条件为见到鬼,注意掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.设NA为阿伏加徳罗常数的值,下列说法不正确的是( )
| A. | 9.2gNO2和N2O4的混合物中含氮原子数目为0.2NA | |
| B. | 常温常压下,35.5g Cl2与足量的NaOH溶液完全反应,转移的电子数为0.5NA | |
| C. | 标准状况下,2.24LNH3与1.6gCH4分子中所含电子数目均为NA | |
| D. | 已知反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,当生成NA个NH3分子时,反应放出的热量小于46.2kJ |
15.X、Y、Z、R是短周期主族元素,X元素是形成有机化合物的必需元素,Y元素的原子最外层电子数是次外层的三倍,Z元素的原子半径是短周期元素中最大的,R原子的核外电子数是X原子核Z原子的核外电子数之和.下列叙述不正确的是( )
| A. | XY2是形成酸雨的主要污染物 | |
| B. | X、Y、R三种元素的非金属性Y>R>X | |
| C. | X、Z分别与R形成的化合物中化学键类型不同 | |
| D. | 含有Y、Z、R三种元素的化合物溶液可能显碱性 |
1.短周期元素X、Y、Z、M的原子序数依次增大,原子X的L层电子数是K层的2倍,Y2+电子层结构与氖相同,Z原子的质子数为偶数,室温下M单质为淡黄色固体,下列有关说法正确的是( )
| A. | X、Y、Z、M的原子半径依次减小 | |
| B. | Y与M组成化合物的熔点高于X与M组成的化合物 | |
| C. | X、Z、M的最低价气态氢化物的热稳定性依次增强 | |
| D. | X的单质与Y、Z的最高价氧化物均能发生置换反应 |
18.化学反应原理是工业合成氨的重要理论基础.
(1)合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,若在恒温、恒压条件下向平衡体系中通入氩气,平衡向左移动(填“向左”、“向右”或“不”);使用催化剂该反应的△H不变(填“增大”、“减小”或“不变”).
(2)在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
下列说法正确的是BD(填字母编号).
A.2c1>c3 B.a+b=92.4 C.2p2<p3 D.a1+a3<1
(3)合成氨在等容条件下进行.改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图1所示:

①N2的平均反应速率vI(N2)、vII(N2)、vIII(N2)从大到小排列次序为vI(N2)>vII(N2)>vIII(N2).
②由第一次平衡到第二次平衡,平衡移动的方向是正向移动,采取的措施是降低了生成物浓度或分离出NH3.
③比较第II阶段反应温度(T2)和第III阶段反应温度(T3)的高低:T2>T3(填“>”、“=”或“<”),判断的理由是此反应为放热反应,降低温度,平衡向正反应方向移动,平衡的移动只能减弱改变,不能抵消改变.
(4)将0.1mol N2和0.3mol H2通入一容积可变的容器中进行工业固氮反应.
①若300℃、压强P2时达到平衡,容器容积恰为10L,则此状态下反应的平衡常数K=22.6(mol•L-1)-2(计算结果保留3位有效数字).
②合成氨反应达到平衡后,t1时刻速率发生如图B变化,此刻可能改变的反应条件是加压或缩小容器体积或增大反应物浓度(回答一种).
(1)合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,若在恒温、恒压条件下向平衡体系中通入氩气,平衡向左移动(填“向左”、“向右”或“不”);使用催化剂该反应的△H不变(填“增大”、“减小”或“不变”).
(2)在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| 平衡时NH3的浓度(mol•L-1) | cl | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收bkJ | 吸收c kj |
| 体系压强(pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
A.2c1>c3 B.a+b=92.4 C.2p2<p3 D.a1+a3<1
(3)合成氨在等容条件下进行.改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图1所示:

①N2的平均反应速率vI(N2)、vII(N2)、vIII(N2)从大到小排列次序为vI(N2)>vII(N2)>vIII(N2).
②由第一次平衡到第二次平衡,平衡移动的方向是正向移动,采取的措施是降低了生成物浓度或分离出NH3.
③比较第II阶段反应温度(T2)和第III阶段反应温度(T3)的高低:T2>T3(填“>”、“=”或“<”),判断的理由是此反应为放热反应,降低温度,平衡向正反应方向移动,平衡的移动只能减弱改变,不能抵消改变.
(4)将0.1mol N2和0.3mol H2通入一容积可变的容器中进行工业固氮反应.
①若300℃、压强P2时达到平衡,容器容积恰为10L,则此状态下反应的平衡常数K=22.6(mol•L-1)-2(计算结果保留3位有效数字).
②合成氨反应达到平衡后,t1时刻速率发生如图B变化,此刻可能改变的反应条件是加压或缩小容器体积或增大反应物浓度(回答一种).
15.W、X、Y、Z均为前三周期元素,W原子种只有质子,没有中子;X原子最外层电子数与次外层电子数相等;Y是短周期主族元素中原子半径最大的元素;Z元素的单质是空气的主要成分之一,且Z元素的单质与Y元素的单质在不同条件下可生成两种不同原子个数比的化合物.下列说法正确的是( )
| A. | W元素无同位素 | |
| B. | X单质分子中含共价键 | |
| C. | 简单离子半径:Y<Z | |
| D. | W、Y、Z不能存在于同一离子化合物中 |
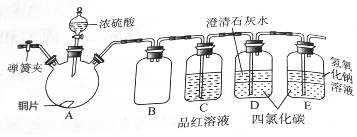 某研究性学习小组为研究Cu与浓硫酸的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出).
某研究性学习小组为研究Cu与浓硫酸的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出).