题目内容
高纯超微细草酸亚铁可用于合成新型锂电池电极材料,工业上可利用提取钛白粉的副产品绿矾(FeSO4?7H2O)通过下列反应制备:
FeSO4+2NH3?H2O=Fe(OH)2↓+(NH4)2SO4
Fe(OH)2+H2C2O4=FeC2O4+2H2O
(1)绿矾中含有一定量的TiOSO4杂质.将绿矾溶于稀硫酸,加入铁粉、搅拌、充分
反应并保持一段时间,过滤,可得纯净的FeSO4溶液.在上述过程中,TiOSO4能与水反应转化为H2TiO3沉淀,写出该反应的化学方程式: ;加入铁粉的作用有 、 .
(2)由纯净的FeSO4溶液制取FeC2O4时,需在真空环境下进行,原因是 .FeC2O4生成后,为提高产品纯度,还需调节溶液pH=2,若pH过低,则导致FeC2O4的产率 (填“偏高”、“偏低”或“无影响”).
(3)将含有FeC2O4的混合液过滤,将产品先用水洗涤,再用无水乙醇清洗.无水乙醇的作用是 、 .
(4)某研究小组欲从某化工残渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备较纯净的FeSO4溶液,再合成FeC2O4.请补充完整由该化工残渣制备较纯净的FeSO4溶液的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量该化工残渣中加入足量的稀硫酸充分反应,过滤, ,过滤,得到较纯净的FeSO4溶液.
FeSO4+2NH3?H2O=Fe(OH)2↓+(NH4)2SO4
Fe(OH)2+H2C2O4=FeC2O4+2H2O
(1)绿矾中含有一定量的TiOSO4杂质.将绿矾溶于稀硫酸,加入铁粉、搅拌、充分
反应并保持一段时间,过滤,可得纯净的FeSO4溶液.在上述过程中,TiOSO4能与水反应转化为H2TiO3沉淀,写出该反应的化学方程式:
(2)由纯净的FeSO4溶液制取FeC2O4时,需在真空环境下进行,原因是
(3)将含有FeC2O4的混合液过滤,将产品先用水洗涤,再用无水乙醇清洗.无水乙醇的作用是
(4)某研究小组欲从某化工残渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备较纯净的FeSO4溶液,再合成FeC2O4.请补充完整由该化工残渣制备较纯净的FeSO4溶液的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量该化工残渣中加入足量的稀硫酸充分反应,过滤,
考点:物质的分离、提纯的基本方法选择与应用,化学平衡的影响因素,制备实验方案的设计
专题:实验设计题,元素及其化合物
分析:(1)根据反应物和生成物写出化学方程式;Fe2+具有较强的还原性,Fe可以与氢离子反应调节PH;
(2)Fe2+被具有很强的还原性,含有Fe2+的氢氧化亚铁、FeC2O4等均容易被空气中的氧气氧化,氢氧化亚铁能与氢离子发生反应;
(3)乙醇具有挥发性,与水相比洗涤后干燥较快,可以降低产品的损耗;
(4)某研究小组欲从某化工残渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备较纯净的FeSO4溶液,弄清楚其思路,向一定量该化工残渣中加入足量加入足量的稀硫酸充分反应,Fe2O3、Al2O3均会与硫酸反应,分别生成Fe2(SO4)2和Al2(SO4)2,SiO2不反应,先过滤把SiO2除去;然后加入过量氢氧化钠溶液让铁离子转化为氢氧化铁沉淀,从而除掉铝离子,然后加稀硫酸溶解氢氧化铁沉淀,最后加铁粉还原.
(2)Fe2+被具有很强的还原性,含有Fe2+的氢氧化亚铁、FeC2O4等均容易被空气中的氧气氧化,氢氧化亚铁能与氢离子发生反应;
(3)乙醇具有挥发性,与水相比洗涤后干燥较快,可以降低产品的损耗;
(4)某研究小组欲从某化工残渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备较纯净的FeSO4溶液,弄清楚其思路,向一定量该化工残渣中加入足量加入足量的稀硫酸充分反应,Fe2O3、Al2O3均会与硫酸反应,分别生成Fe2(SO4)2和Al2(SO4)2,SiO2不反应,先过滤把SiO2除去;然后加入过量氢氧化钠溶液让铁离子转化为氢氧化铁沉淀,从而除掉铝离子,然后加稀硫酸溶解氢氧化铁沉淀,最后加铁粉还原.
解答:
解:(1)反应物为TiOSO4和2H2O,已知为产物为H2TiO3,根据据原子守恒可知另一产物为硫酸,因此化学方程式为:TiOSO4+2H2O=H2TiO3↓+H2SO4;由于Fe2+被具有很强的还原性,容易被氧化为Fe3+,铁粉的还原性比Fe2+强,因此可以防止Fe2+被氧化,另外Fe能与H+反应生成Fe2+,降低了氢离子的浓度,
故答案为:TiOSO4+2H2O=H2TiO3↓+H2SO4;防止Fe2+被氧化、调节溶液pH;
(2)由纯净的FeSO4溶液制取FeC2O4时,反应中的Fe(OH)2等物质具有强还原性,容易被空气中的氧气氧化,所以要在真空中进行,中间产物Fe(OH)2能与H+,如果溶液酸性过强,则会使FeC2O4的产率下降,
故答案为:避免生成的Fe(OH)2等物质被氧化;偏低;
(3)无论水洗还是醇洗目的都是除去产品表面吸附的杂质,乙醇具有挥发性,与水相比洗涤后干燥较快,可以降低产品的损耗等优点,
故答案为:除去固体表面的杂质、使产品快速干燥、减少产品的损耗等;
(4)向一定量该化工残渣中加入足量加入足量的稀硫酸充分反应后,二氧化硅不反应过滤除掉,Fe2O3、Al2O3均会与硫酸反应分别生成Fe2(SO4)2和Al2(SO4)2,然后加入过量氢氧化钠溶液让铁离子转化为氢氧化铁沉淀,过滤得到氢氧化铁沉淀,然后加稀硫酸溶解氢氧化铁沉淀,最后加入过量的铁粉把硫酸铁还原为硫酸亚铁,最后过滤掉过量部分的铁粉,即可得到较纯净的FeSO4溶液,
故答案为:向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体中加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后.
故答案为:TiOSO4+2H2O=H2TiO3↓+H2SO4;防止Fe2+被氧化、调节溶液pH;
(2)由纯净的FeSO4溶液制取FeC2O4时,反应中的Fe(OH)2等物质具有强还原性,容易被空气中的氧气氧化,所以要在真空中进行,中间产物Fe(OH)2能与H+,如果溶液酸性过强,则会使FeC2O4的产率下降,
故答案为:避免生成的Fe(OH)2等物质被氧化;偏低;
(3)无论水洗还是醇洗目的都是除去产品表面吸附的杂质,乙醇具有挥发性,与水相比洗涤后干燥较快,可以降低产品的损耗等优点,
故答案为:除去固体表面的杂质、使产品快速干燥、减少产品的损耗等;
(4)向一定量该化工残渣中加入足量加入足量的稀硫酸充分反应后,二氧化硅不反应过滤除掉,Fe2O3、Al2O3均会与硫酸反应分别生成Fe2(SO4)2和Al2(SO4)2,然后加入过量氢氧化钠溶液让铁离子转化为氢氧化铁沉淀,过滤得到氢氧化铁沉淀,然后加稀硫酸溶解氢氧化铁沉淀,最后加入过量的铁粉把硫酸铁还原为硫酸亚铁,最后过滤掉过量部分的铁粉,即可得到较纯净的FeSO4溶液,
故答案为:向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体中加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后.
点评:本题考查氧化还原反应、离子除杂等相关知识,突出检验学生信息收集、整合、分析问题解决问题的能力,试题开放性强,有些答案不唯一,整体难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化.①~⑧为各装置中的电极编号.下列说法错误的是( )
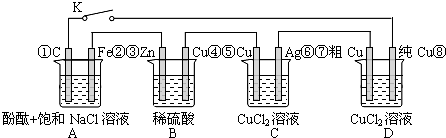

| A、当K闭合时,A装置发生吸氧腐蚀,在电路中做电源 |
| B、当K断开时,B装置锌片溶解,有氢气产生 |
| C、当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→② |
| D、当K闭合后,A、B装置中pH变大,C、D装置中pH不变 |
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
| A、溶液中导电能力增强 |
| B、溶液中c(H+)/c(CH3COOH)增大 |
| C、醋酸的电离程度增大,c(H+)亦增大 |
| D、电离平衡左移 |
化学与生产生活密切相关,下列说法中正确的是( )
| A、从安全的角度考虑,金属钠着火时,应立即用水将其扑灭 |
| B、氢氧化铁溶胶、乙酸与乙醇的混合液、含PM2.5的大气均为胶体 |
| C、纤维素在人体内可发生水解反应,故可做人类的营养物质 |
| D、石英可用于生产光导纤维 |
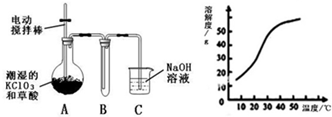 Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.