题目内容
假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化.①~⑧为各装置中的电极编号.下列说法错误的是( )
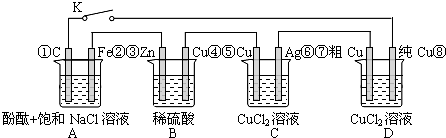

| A、当K闭合时,A装置发生吸氧腐蚀,在电路中做电源 |
| B、当K断开时,B装置锌片溶解,有氢气产生 |
| C、当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→② |
| D、当K闭合后,A、B装置中pH变大,C、D装置中pH不变 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:当K闭合时,B装置能自发的进行氧化还原反应,为原电池,A和C、D为电解池,放电时,导致电子从负极流向阴极,再从阳极流向正极,根据溶液中氢离子或氢氧根离子浓度变化确定溶液pH变化;
当K断开时,该装置不能形成闭合回路而不能构成原电池和电解池.
当K断开时,该装置不能形成闭合回路而不能构成原电池和电解池.
解答:
解:A.当K闭合时,B能发生剧烈的氧化还原反应而作原电池,A为电解池,铁作阴极被保护,故A错误;
B.当K断开时,该在不能形成原电池和电解池,但B装置锌片能和稀硫酸发生置换反应而溶解,同时有氢气产生,故B正确;
C.当K闭合后,B作原电池A和C、D作电解池,B中锌作负极铜作正极,A中铁作阴极、C作阳极,C中Cu作阳极、Ag作阴极,D中粗铜作阳极、纯铜作阴极,电子从负极流向阴极,再从阳极流向正极,所以电子移动方向为:①→⑧;⑦→⑥;⑤→④;③→②,故C正确;
D.当K闭合后,A中阴极上氢离子放电,阳极上氯离子放电,导致溶液氢氧根离子浓度增大,溶液的pH增大;
B中正极上氢离子放电导致氢离子浓度减小,溶液的pH增大;
C为电镀池,溶液的pH不变;
D为电解精炼粗铜,阳极上金属失电子,阴极上铜离子得电子,所以溶液中pH不变,故D正确;
故选A.
B.当K断开时,该在不能形成原电池和电解池,但B装置锌片能和稀硫酸发生置换反应而溶解,同时有氢气产生,故B正确;
C.当K闭合后,B作原电池A和C、D作电解池,B中锌作负极铜作正极,A中铁作阴极、C作阳极,C中Cu作阳极、Ag作阴极,D中粗铜作阳极、纯铜作阴极,电子从负极流向阴极,再从阳极流向正极,所以电子移动方向为:①→⑧;⑦→⑥;⑤→④;③→②,故C正确;
D.当K闭合后,A中阴极上氢离子放电,阳极上氯离子放电,导致溶液氢氧根离子浓度增大,溶液的pH增大;
B中正极上氢离子放电导致氢离子浓度减小,溶液的pH增大;
C为电镀池,溶液的pH不变;
D为电解精炼粗铜,阳极上金属失电子,阴极上铜离子得电子,所以溶液中pH不变,故D正确;
故选A.
点评:本题考查了原电池和电解池原理,正确判断哪个是原电池、哪个是电解池是解本题关键,再结合各个电极上发生的电极反应来分析解答,注意反应过程中,电子不进入电解质溶液,为易错点.

练习册系列答案
 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒.我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:
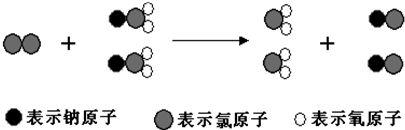
下列有关叙述中正确的是( )

下列有关叙述中正确的是( )
| A、该反应是复分解反应 |
| B、ClO2 的消毒效率(等质量时得到电子的多少)是Cl2 的2.63倍 |
| C、反应中Cl2既是氧化剂,又是还原剂 |
| D、生成2mol ClO2时转移的电子数为6mol |
下列各组离子在指定环境中一定能大量共存的是( )
| A、使pH试纸显蓝色的溶液中:Cu2+、NO3-、Fe3+、SO42- |
| B、与铝粉反应放出氢气的无色溶液中:NO3-、Al3+、Na+、SO42- |
| C、使红色石蕊试纸变蓝的溶液中:SO42-、CO32-、Na+、K+ |
| D、pH=0的溶液中:Al3+、NH4+、Ca2+、ClO- |
“复盐”是指含多种简单阳离子和一种酸根离子组成的盐,如KAl(SO4)2.而一种金属离子与多种酸根离子构成的盐则称为“混盐”,如氯化硝酸钙[Ca(NO3)2Cl].下列化合物属于混盐的是( )
| A、Ca2O2Cl4 |
| B、KCl?MgCl2?6H2O |
| C、KMnO4 |
| D、Cu2(OH)2CO3 |
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )
| A、饱和纯碱(Na2CO3)溶液中:c(Na+)=2c(CO32-) |
| B、pH=4的醋酸中:c(H+)=1.0×10-4mol?L-1 |
| C、0.10mol/L醋酸钠溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| D、pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1 |
 化学反应原理在科研和生产中有广泛应用.
化学反应原理在科研和生产中有广泛应用.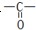 和C-OH两种原子团,A可能的结构简式为(写出一种即可)
和C-OH两种原子团,A可能的结构简式为(写出一种即可)