题目内容
已知实验室制氯气的化学方程式为:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O,其中:
(1)MnO2中Mn元素被 .(填“氧化”或“还原”)
(2)HCl中氯原子 (填“得到”或“失去”)电子.
(3)反应中还原剂与氧化剂的物质的量之比为 .
(4)标出此反应中电子转移情况.MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O .
(1)MnO2中Mn元素被
(2)HCl中氯原子
(3)反应中还原剂与氧化剂的物质的量之比为
(4)标出此反应中电子转移情况.MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
考点:氧化还原反应
专题:氧化还原反应专题
分析:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,Cl元素的化合价升高,结合氧化还原反应中基本概念来解答.
解答:
解:(1)因Mn元素的化合价降低,则得到电子被还原,故答案为:还原;
(2)Cl元素的化合价升高,则Cl失去电子,故答案为:失去;
(3)MnO2为氧化剂,HCl为还原剂,由电子守恒可知,还原剂与氧化剂的物质的量之比为2:1,故答案为:2:1;
(4)Mn元素的化合价由+4价降低为+2价,该反应中转移2e-,转移电子为 ;
;
故答案为: .
.
(2)Cl元素的化合价升高,则Cl失去电子,故答案为:失去;
(3)MnO2为氧化剂,HCl为还原剂,由电子守恒可知,还原剂与氧化剂的物质的量之比为2:1,故答案为:2:1;
(4)Mn元素的化合价由+4价降低为+2价,该反应中转移2e-,转移电子为
 ;
;故答案为:
 .
.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重基本概念及转移电子的考查,题目难度不大.

练习册系列答案
相关题目
ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒.我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:
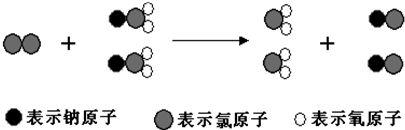
下列有关叙述中正确的是( )

下列有关叙述中正确的是( )
| A、该反应是复分解反应 |
| B、ClO2 的消毒效率(等质量时得到电子的多少)是Cl2 的2.63倍 |
| C、反应中Cl2既是氧化剂,又是还原剂 |
| D、生成2mol ClO2时转移的电子数为6mol |
电化学降解法可用于治理水中硝酸盐的污染.降解NO3-的原理如图所示.下列说法不正确的是( )

| A、直流电源A为正极、B为负极 |
| B、当电解过程中质子从Pt电极向Ag-Pt电极移动 |
| C、在阳极发生的电极反应:2H2O-4e-=O2+4H+ |
| D、当电解过程转移2mol电子时,阴极室质量减少5.6g |

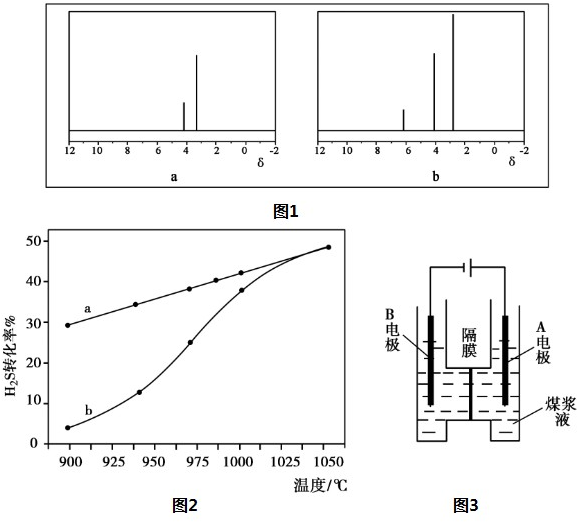
 化学反应原理在科研和生产中有广泛应用.
化学反应原理在科研和生产中有广泛应用.