题目内容
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
| A、溶液中导电能力增强 |
| B、溶液中c(H+)/c(CH3COOH)增大 |
| C、醋酸的电离程度增大,c(H+)亦增大 |
| D、电离平衡左移 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:A.加水稀释,溶液中离子浓度减小;
B.醋酸是弱电解质,加水稀释促进醋酸电离,氢离子物质的量增大,醋酸分子的物质的量减少;
C.加水稀释促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度;
D.加水稀释促进醋酸电离.
B.醋酸是弱电解质,加水稀释促进醋酸电离,氢离子物质的量增大,醋酸分子的物质的量减少;
C.加水稀释促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度;
D.加水稀释促进醋酸电离.
解答:
解:A.加水稀释,溶液中离子浓度减小,所以导电性减弱,故A错误;
B.醋酸是弱电解质,加水稀释促进醋酸电离,氢离子物质的量增大,醋酸分子的物质的量减少,则溶液中
=
增大,故B正确;
C.加水稀释促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度,所以醋酸的电离程度增大,但c(H+)减小,故C错误;
D.加水稀释促进醋酸电离,醋酸的电离平衡右移,故D错误;
故选B.
B.醋酸是弱电解质,加水稀释促进醋酸电离,氢离子物质的量增大,醋酸分子的物质的量减少,则溶液中
| c(H+) |
| c(CH3COOH) |
| n(H+) |
| n(CH3COOH) |
C.加水稀释促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度,所以醋酸的电离程度增大,但c(H+)减小,故C错误;
D.加水稀释促进醋酸电离,醋酸的电离平衡右移,故D错误;
故选B.
点评:本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,注意稀释醋酸过程中电离度的变化与溶液中离子浓度的变化,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒.我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:
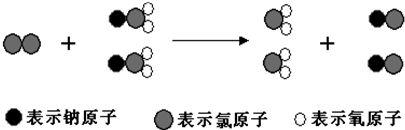
下列有关叙述中正确的是( )

下列有关叙述中正确的是( )
| A、该反应是复分解反应 |
| B、ClO2 的消毒效率(等质量时得到电子的多少)是Cl2 的2.63倍 |
| C、反应中Cl2既是氧化剂,又是还原剂 |
| D、生成2mol ClO2时转移的电子数为6mol |
下列各组离子在指定环境中一定能大量共存的是( )
| A、使pH试纸显蓝色的溶液中:Cu2+、NO3-、Fe3+、SO42- |
| B、与铝粉反应放出氢气的无色溶液中:NO3-、Al3+、Na+、SO42- |
| C、使红色石蕊试纸变蓝的溶液中:SO42-、CO32-、Na+、K+ |
| D、pH=0的溶液中:Al3+、NH4+、Ca2+、ClO- |
将含有KCl,CuBr2,Na2SO4 三种物质的水溶液(分别为1mol/L)用铂电极进行电解至足够长时间.有以下结论:①溶液中几乎没有Br-;②电解液变为无色;③最终溶液呈碱性;④K+,Na+和SO42-的浓度几乎没有变化.正确的是( )
| A、①②③ | B、仅③ |
| C、①④ | D、均正确 |
“复盐”是指含多种简单阳离子和一种酸根离子组成的盐,如KAl(SO4)2.而一种金属离子与多种酸根离子构成的盐则称为“混盐”,如氯化硝酸钙[Ca(NO3)2Cl].下列化合物属于混盐的是( )
| A、Ca2O2Cl4 |
| B、KCl?MgCl2?6H2O |
| C、KMnO4 |
| D、Cu2(OH)2CO3 |
电化学降解法可用于治理水中硝酸盐的污染.降解NO3-的原理如图所示.下列说法不正确的是( )

| A、直流电源A为正极、B为负极 |
| B、当电解过程中质子从Pt电极向Ag-Pt电极移动 |
| C、在阳极发生的电极反应:2H2O-4e-=O2+4H+ |
| D、当电解过程转移2mol电子时,阴极室质量减少5.6g |