题目内容
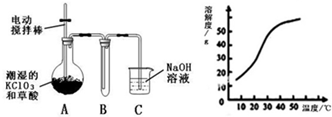 Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.(1)A必须添加温度控制装置,除酒精灯、温度计外,还需要的玻璃仪器有
(2)反应后在装置C中可得NaClO2溶液.已知在温度低于38℃时NaClO2饱和溶液中析出晶体是NaClO2?3H2O,在温度高于38℃时析出晶体是NaClO2.根据图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:①蒸发结晶;②
(3)ClO2很不稳定,需随用随制,用水吸收得到ClO2溶液.为测定所得溶液中ClO2的浓度,进行了下列实验:
①准确量取ClO2溶液V1 mL加入到锥形瓶中,加适量蒸馏水稀释,调节试样的pH≤2.0.
②加入足量的KI晶体,静置片刻.此时发生反应的离子方程式为:
③加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定,至终点时消耗Na2S2O3溶液V2 mL.则原ClO2溶液的浓度为
Ⅱ.将由Na+、Ba2+、Cu2+、SO42-、Cl-组合形成的三种强电解质溶液,分别装入如图装置中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极.

接通电源,经过一段时间后,测得乙中c电极质量增加.常温下各烧杯中溶液pH与电解时间t的关系如图(忽略因气体溶解带来的影响).据此回答下列问题:
(1)写出乙烧杯中发生反应的化学方程式
(2)电极f上发生的电极反应为
(3)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是
考点:氯、溴、碘及其化合物的综合应用,电解原理
专题:电化学专题,卤族元素
分析:(1)根据反应需要的温度介于60~100℃之间的要采用水浴加热;
(2)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法,根据题意温度高于38℃时析出晶体是NaClO2来确定过滤的温度;
(3)②二氧化氯具有氧化性,可以将碘离子氧化为碘单质,据此书写方程式;
③根据关系式2ClO2~5I2~10Na2S2O3计算c(ClO2);
Ⅱ、乙中c电极质量增加,说明c属于阴极,所以d是阳极,则M是负极,N是正极,f是阳极,e是阴极,b是阳极,a是阴极,根据电解后溶液pH的变化可知甲中的电解质是NaCl,乙中的电解质是CuSO4,丙中的电解质是Na2SO4,根据电解池的工作原理以及电子守恒来书写电解方程式并进行计算即可.
(2)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法,根据题意温度高于38℃时析出晶体是NaClO2来确定过滤的温度;
(3)②二氧化氯具有氧化性,可以将碘离子氧化为碘单质,据此书写方程式;
③根据关系式2ClO2~5I2~10Na2S2O3计算c(ClO2);
Ⅱ、乙中c电极质量增加,说明c属于阴极,所以d是阳极,则M是负极,N是正极,f是阳极,e是阴极,b是阳极,a是阴极,根据电解后溶液pH的变化可知甲中的电解质是NaCl,乙中的电解质是CuSO4,丙中的电解质是Na2SO4,根据电解池的工作原理以及电子守恒来书写电解方程式并进行计算即可.
解答:
解:I.(1)KClO3和草酸(H2C2O4)在60℃时的反应来制取目标产物,需要的温度介于60~100℃之间的要采用水浴加热,所以还缺少盛水的装置:烧杯,
故答案为:烧杯;
(2)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法,并且只有温度高于38℃时析出晶体才是NaClO2,所以要趁热过滤,故答案为:趁热过滤;
(3)②二氧化氯具有氧化性,可以将碘离子氧化为碘单质,2ClO2+8H++10I-═2Cl-+5I2+4H2O,故答案为:2ClO2+8H++10I-═2Cl-+5I2+4H2O;
③设原ClO2溶液的浓度为x,
2ClO2~5I2~10Na2S2O3
2 10
10-3×xV1 10-3×cV2
解得x=
,故答案为:
;
Ⅱ.乙中c电极质量增加,说明c属于阴极,所以d是阳极,则M是负极,N是正极,f是阳极,e是阴极,b是阳极,a是阴极,根据电解后溶液pH的变化可知甲中的电解质是NaCl,乙中的电解质是CuSO4,丙中的电解质是Na2SO4,
(1)乙烧杯为电解硫酸铜溶液,反应的总反应式为2CuSO4+2H2O
2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4;
(2)丙为电解硫酸钠溶液,f为阳极,电极f上发生的电极反应为4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
(3)c电极质量增加了8g,为Cu,n(Cu)=
=0.125mol,转移0.25mol电子,丙中发生2H2O
O2↑+2H2↑,转移0.25mol电子应消耗0.125mol水,质量为0.125mol×18g/mol=2.25g,应加入2.25g水可恢复到原来的浓度,
故答案为:向丙烧杯中加入2.25g水.
故答案为:烧杯;
(2)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法,并且只有温度高于38℃时析出晶体才是NaClO2,所以要趁热过滤,故答案为:趁热过滤;
(3)②二氧化氯具有氧化性,可以将碘离子氧化为碘单质,2ClO2+8H++10I-═2Cl-+5I2+4H2O,故答案为:2ClO2+8H++10I-═2Cl-+5I2+4H2O;
③设原ClO2溶液的浓度为x,
2ClO2~5I2~10Na2S2O3
2 10
10-3×xV1 10-3×cV2
解得x=
| cV2 |
| 5V1 |
| cV2 |
| 5V1 |
Ⅱ.乙中c电极质量增加,说明c属于阴极,所以d是阳极,则M是负极,N是正极,f是阳极,e是阴极,b是阳极,a是阴极,根据电解后溶液pH的变化可知甲中的电解质是NaCl,乙中的电解质是CuSO4,丙中的电解质是Na2SO4,
(1)乙烧杯为电解硫酸铜溶液,反应的总反应式为2CuSO4+2H2O
| ||
| ||
(2)丙为电解硫酸钠溶液,f为阳极,电极f上发生的电极反应为4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
(3)c电极质量增加了8g,为Cu,n(Cu)=
| 8g |
| 64g/mol |
| ||
故答案为:向丙烧杯中加入2.25g水.
点评:本题是一道综合知识的考查题,涉及物质的制备实验,电解池的工作原理等方面知识,综合性强,难度大.

练习册系列答案
相关题目
下列各组离子能大量共存的是( )
| A、NH4+、Na+、NO3-、OH- |
| B、Ca2+、Na+、Cl-、CO32- |
| C、K+、H+、SO42-、OH- |
| D、Na+、K+、OH-、Cl- |

 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: