题目内容
一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通丙烷和氧气,其电池反应式为: ,通丙烷的电极为 极,其对应的电极反应式为 .参加反应的
O2和C3H8的物质的量比为 .
已知11g的丙烷气体完全燃烧生成二氧化碳和液态的水,放出555.4KJ的热量,写出其热化学方程式 .
O2和C3H8的物质的量比为
已知11g的丙烷气体完全燃烧生成二氧化碳和液态的水,放出555.4KJ的热量,写出其热化学方程式
考点:化学电源新型电池,热化学方程式,电极反应和电池反应方程式
专题:
分析:燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应,根据电池反应式确定氧气和丙烷的物质的量之比;
11g的丙烷的物质的量=
=0.25mol,11g的丙烷气体完全燃烧生成二氧化碳和液态的水,放出555.4KJ的热量,则1mol丙烷完全燃烧放出的热量为2221.6kJ,据此书写热化学方程式.
11g的丙烷的物质的量=
| 11g |
| 44g/mol |
解答:
解:该燃料电池中,负极上丙烷失电子发生氧化反应,正极上氧气得电子发生还原反应,所以电池反应式为:C3H8+5O2+6OH-=3CO32-+7H2O,负极上丙烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为C3H8-20e-+26OH-=3CO32-+17H2O,根据电池反应式知,氧气和丙烷的物质的量之比为5:1,
11g的丙烷的物质的量=
=0.25mol,11g的丙烷气体完全燃烧生成二氧化碳和液态的水,放出555.4kJ的热量,则1mol丙烷完全燃烧放出的热量为2221.6kJ,其热化学反应方程式为:
C3H8( g )+5O2( g )=3CO2( g )+4H2O ( l );△H=-2221.6kJ/mol,
故答案为:C3H8+5O2+6OH-=3CO32-+7H2O,负极;C3H8-20e-+26OH-=3CO32-+17H2O,5:1;
C3H8( g )+5O2( g )=3CO2( g )+4H2O ( l );△H=-2221.6kJ/mol.
11g的丙烷的物质的量=
| 11g |
| 44g/mol |
C3H8( g )+5O2( g )=3CO2( g )+4H2O ( l );△H=-2221.6kJ/mol,
故答案为:C3H8+5O2+6OH-=3CO32-+7H2O,负极;C3H8-20e-+26OH-=3CO32-+17H2O,5:1;
C3H8( g )+5O2( g )=3CO2( g )+4H2O ( l );△H=-2221.6kJ/mol.
点评:本题考查了燃料电池,燃料电池中通入燃料的电极为负极,通入氧化剂的电极为正极,根据得失电子书写电极反应式,并结合电解质溶液酸碱性书写,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组离子在指定环境中一定能大量共存的是( )
| A、使pH试纸显蓝色的溶液中:Cu2+、NO3-、Fe3+、SO42- |
| B、与铝粉反应放出氢气的无色溶液中:NO3-、Al3+、Na+、SO42- |
| C、使红色石蕊试纸变蓝的溶液中:SO42-、CO32-、Na+、K+ |
| D、pH=0的溶液中:Al3+、NH4+、Ca2+、ClO- |
下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A、1.8g NH4+ 所含质子数为NA |
| B、通常状况下,NA个CO2分子占有的体积为22.4 L |
| C、物质的量浓度为0.5mol/L的BaCl2溶液中,含有Cl-个数为NA |
| D、1 mol?L-1的CaCl2溶液中,Cl-的物质的量浓度为2 mol?L-1 |
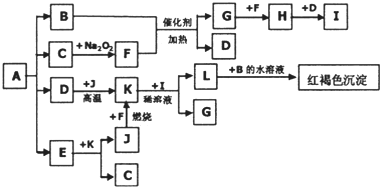
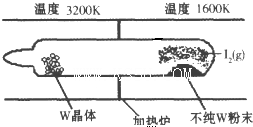 化学反应原理在科研和生产中有广泛应用.
化学反应原理在科研和生产中有广泛应用.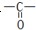 和C-OH两种原子团,A可能的结构简式为(写出一种即可)
和C-OH两种原子团,A可能的结构简式为(写出一种即可)