题目内容
Ⅰ已知:①H2(g)+
O2(g)═H2O(l)△H=-285.8kJ?mol-1
②H2(g)+
O2(g)═H2O(g)△H=-241.8kJ?mol-1
③C(s)+
O2(g)═CO(g)△H=-110.5kJ?mol-1
④C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
回答下列问题:
(1)上述反应中属于放热反应的是 .
(2)H2的燃烧热为 ,C的燃烧热为 .
(3)燃烧l0gH2 生成液态水,放出的热量为 .
(4)CO的燃烧热为 ,其热化学方程式为 .
Ⅱ在一定条件下:xA+yB?zC的反应达到平衡.
(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z之间的关系是 ;
(2)已知C是气体,且x+y=z,在增大压强时,如果平衡发生移动,则 移动.
(填“正向”、“逆向”或“无法判断”)
(3)已知B、C是气体,当其他条件不变,增大A的物质的量时,平衡不移动,则A是 态.(填“气”、“液”或“固”)
(4)加热后C的质量分数减少,则正反应是 反应.(填“吸热”或“放热”)
| 1 |
| 2 |
②H2(g)+
| 1 |
| 2 |
③C(s)+
| 1 |
| 2 |
④C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
回答下列问题:
(1)上述反应中属于放热反应的是
(2)H2的燃烧热为
(3)燃烧l0gH2 生成液态水,放出的热量为
(4)CO的燃烧热为
Ⅱ在一定条件下:xA+yB?zC的反应达到平衡.
(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z之间的关系是
(2)已知C是气体,且x+y=z,在增大压强时,如果平衡发生移动,则
(填“正向”、“逆向”或“无法判断”)
(3)已知B、C是气体,当其他条件不变,增大A的物质的量时,平衡不移动,则A是
(4)加热后C的质量分数减少,则正反应是
考点:化学平衡的影响因素,燃烧热
专题:
分析:Ⅰ(1)反应中△H<0的属于放热反应;
(2)燃烧热的概念判断;
(3)10g氢气的物质的量=
=5mol,根据氢气的燃烧热判断;
(4)根据盖斯定律计算;
Ⅱ在一定条件下:xA+yB?zC的反应达到平衡.
(1)减小压强,平衡向气体体积增大的方向移动;
(2)已知C是气体,且x+y=z,在增大压强时,如果平衡发生移动,平衡向气体体积减小的方向移动;
(3)固体或液体不影响平衡移动;
(4)升高温度,平衡向吸热反应方向移动.
(2)燃烧热的概念判断;
(3)10g氢气的物质的量=
| 10g |
| 2g/mol |
(4)根据盖斯定律计算;
Ⅱ在一定条件下:xA+yB?zC的反应达到平衡.
(1)减小压强,平衡向气体体积增大的方向移动;
(2)已知C是气体,且x+y=z,在增大压强时,如果平衡发生移动,平衡向气体体积减小的方向移动;
(3)固体或液体不影响平衡移动;
(4)升高温度,平衡向吸热反应方向移动.
解答:
解:I(1)反应中△H<0的属于放热反应,根据热化学反应方程式知,属于放热反应的是①②③④,故答案为:①②③④;
(2)根据热化学反应方程式知,H2的燃烧热为285.8kJ?mol-1,C的燃烧热为393.5kJ?mol-1,故答案为:285.8kJ?mol-1;393.5kJ?mol-1;
(3)1mol氢气完全燃烧生成液态水放出的热量为285.8kJ,10g氢气的物质的量=
=5mol,则燃烧l0gH2 生成液态水,放出的热量=285.8kJ×5=1429kJ,
故答案为:1429kJ;
(4)③C(s)+
O2(g)═CO(g)△H=-110.5kJ?mol-1
④C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
将方程式④-③得CO(g)+
O2(g)═CO2(g)△H=-393.5kJ?mol-1-(-110.5 kJ?mol-1)=-283 kJ?mol-1,
所以CO的燃烧热为-283 kJ?mol-1,热化学方程式为CO(g)+
O2(g)═CO2(g)△H=-283 kJ?mol-1,
故答案为:-283 kJ?mol-1;热化学方程式为CO(g)+
O2(g)═CO2(g)△H=-283 kJ?mol-1 ;
II在一定条件下:xA+yB?zC的反应达到平衡.
(1)A、B、C都是气体,减小压强,平衡向气体体积增大的方向移动,则x+y>z,故答案为:x+y>z;
(2)已知C是气体,且x+y=z,在增大压强时,如果平衡发生移动,则反应物中有固体或液体,所以反应物气体体积之和小于生成物,所以平衡向逆向移动,故答案为:逆向;
(3)增大固体或液体的量,可逆反应的平衡不移动,B、C是气体,当其他条件不变,增大A的物质的量时,平衡不移动,则A是固或液态,故答案为:固或液;
(4)升高温度平衡向吸热反应方向移动,加热后C的质量分数减少,则平衡向逆反应方向移动,逆反应方向是吸热反应,则正反应是放热反应,故答案为:放热.
(2)根据热化学反应方程式知,H2的燃烧热为285.8kJ?mol-1,C的燃烧热为393.5kJ?mol-1,故答案为:285.8kJ?mol-1;393.5kJ?mol-1;
(3)1mol氢气完全燃烧生成液态水放出的热量为285.8kJ,10g氢气的物质的量=
| 10g |
| 2g/mol |
故答案为:1429kJ;
(4)③C(s)+
| 1 |
| 2 |
④C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
将方程式④-③得CO(g)+
| 1 |
| 2 |
所以CO的燃烧热为-283 kJ?mol-1,热化学方程式为CO(g)+
| 1 |
| 2 |
故答案为:-283 kJ?mol-1;热化学方程式为CO(g)+
| 1 |
| 2 |
II在一定条件下:xA+yB?zC的反应达到平衡.
(1)A、B、C都是气体,减小压强,平衡向气体体积增大的方向移动,则x+y>z,故答案为:x+y>z;
(2)已知C是气体,且x+y=z,在增大压强时,如果平衡发生移动,则反应物中有固体或液体,所以反应物气体体积之和小于生成物,所以平衡向逆向移动,故答案为:逆向;
(3)增大固体或液体的量,可逆反应的平衡不移动,B、C是气体,当其他条件不变,增大A的物质的量时,平衡不移动,则A是固或液态,故答案为:固或液;
(4)升高温度平衡向吸热反应方向移动,加热后C的质量分数减少,则平衡向逆反应方向移动,逆反应方向是吸热反应,则正反应是放热反应,故答案为:放热.
点评:本题考查了化学平衡的影响因素、热化学反应等知识点,根据盖斯定律、外界条件对化学平衡的影响来分析解答,化学平衡还常常考查“根据图象判断改变条件”及化学平衡常数的计算等知识点,注意燃烧热中几个关键词“稳定氧化物、1mol燃料、完全燃料”为易错点.

练习册系列答案
相关题目
下列离子方程式中正确的是( )
| A、碳酸钡和稀盐酸反应:CO32-+2H+═H2O+CO2↑ |
| B、钠与水的反应:2Na+2H2O═2Na++2OH-+H2↑ |
| C、将CO2气体通入澄清石灰水中:CO2+Ca(OH)2═CaCO3↓+H2O |
| D、H2SO4与Ba(OH)2溶液反应:Ba2++OH+H++SO42-═BaSO4↓+H2O |
ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒.我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:
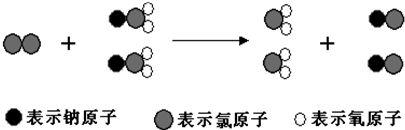
下列有关叙述中正确的是( )

下列有关叙述中正确的是( )
| A、该反应是复分解反应 |
| B、ClO2 的消毒效率(等质量时得到电子的多少)是Cl2 的2.63倍 |
| C、反应中Cl2既是氧化剂,又是还原剂 |
| D、生成2mol ClO2时转移的电子数为6mol |
将含有KCl,CuBr2,Na2SO4 三种物质的水溶液(分别为1mol/L)用铂电极进行电解至足够长时间.有以下结论:①溶液中几乎没有Br-;②电解液变为无色;③最终溶液呈碱性;④K+,Na+和SO42-的浓度几乎没有变化.正确的是( )
| A、①②③ | B、仅③ |
| C、①④ | D、均正确 |
下列各组物质属于同分异构体的是( )
| A、金刚石和富勒烯(C60) |
B、CH3CH2CH2CH3和 |
| C、12CO和14CO |
| D、CH3CH3 和CH3CH2CH3 |
 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: