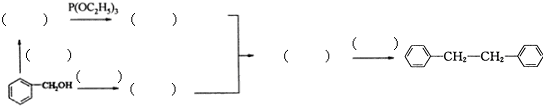
题目内容
海带含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: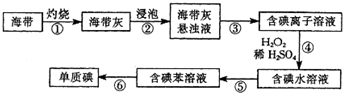
请填写下列空白:
(1)步骤③和⑤的实验操作名称分别是 、 .
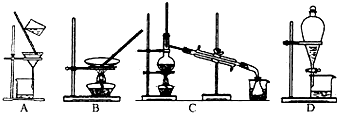
(2)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤应选择的实验装置是 .
(3)步骤④反应的离子方程式是 .
(4)请设计一个简单的实验方案,检验提取碘后的水溶液中是否还含有单质碘: .

请填写下列空白:
(1)步骤③和⑤的实验操作名称分别是
(2)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤应选择的实验装置是

(3)步骤④反应的离子方程式是
(4)请设计一个简单的实验方案,检验提取碘后的水溶液中是否还含有单质碘:
考点:海带成分中碘的检验
专题:
分析:(1)分离固体和液体用过滤,分离互溶的两种液体且沸点相差不大的物质用蒸馏;
(2)分离互溶的两种液体用蒸馏;
(3)H2O2具有较强的氧化性,在酸性条件下可氧化碘离子.
(4)根据淀粉遇碘变蓝的性质来检验;
(2)分离互溶的两种液体用蒸馏;
(3)H2O2具有较强的氧化性,在酸性条件下可氧化碘离子.
(4)根据淀粉遇碘变蓝的性质来检验;
解答:
解:(1)步骤③是分离固体和液体,则实验操作为过滤,步骤⑤是将碘单质从碘水中分离出来,实验操作为萃取分液,
故答案为:过滤;萃取分液;
(2)步骤⑥是利用互溶的两种液体的沸点不同来分离,则实验操作为蒸馏,
故答案为:C;
(3)碘离子在酸性条件下可被H2O2氧化成单质碘,H2O2被还原为水,反应的离子方程式为2I-+H2O2+2H+=I2+2H2O,
故答案为:2I-+H2O2+2H+=I2+2H2O.
(4)由于淀粉遇碘单质会变蓝,故取少量溶液于试管中,滴加少量淀粉溶液,若溶液变蓝,说明原溶液中含有单质碘,反之则无.
故答案为:取少量溶液于试管中,滴加少量淀粉溶液,若溶液变蓝,说明原溶液中含有单质碘,反之则无.
故答案为:过滤;萃取分液;
(2)步骤⑥是利用互溶的两种液体的沸点不同来分离,则实验操作为蒸馏,
故答案为:C;
(3)碘离子在酸性条件下可被H2O2氧化成单质碘,H2O2被还原为水,反应的离子方程式为2I-+H2O2+2H+=I2+2H2O,
故答案为:2I-+H2O2+2H+=I2+2H2O.
(4)由于淀粉遇碘单质会变蓝,故取少量溶液于试管中,滴加少量淀粉溶液,若溶液变蓝,说明原溶液中含有单质碘,反之则无.
故答案为:取少量溶液于试管中,滴加少量淀粉溶液,若溶液变蓝,说明原溶液中含有单质碘,反之则无.
点评:本题考查灼烧的实验,物质的分离方法,难度适中,注意从框图关系找出解题突破口.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
天然碱的化学式表示为2Na2CO3?NaHCO3?2H2O,取少量该物质溶于水得到稀溶液,在溶液中逐滴加入稀盐酸.下列离子方程式与事实不相符的是( )
| A、HCO3-+CO32-+3H+→2H2O+2CO2↑ |
| B、2HCO3-+CO32-+4H+→3H2O+3CO2↑ |
| C、CO32-+H+→HCO3- |
| D、HCO3-+3CO32-+7H+→4H2O+4CO2↑ |
下列溶液一定呈中性的是( )
| A、pH=7的溶液 |
| B、pH=2的CH3COOH和pH=12的NaOH溶液等体积混合 |
| C、CH3COONa溶液 |
| D、c(NH+4)=c(Cl-)的NH4Cl和氨水的混合溶液 |
常温时,Ksp[Mg(OH)2]=1.1×10-11,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,Ksp(CH3COOAg)=2.3×10-3,下列叙述不正确的是( )
| A、在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
| B、浓度均为0.2 mol?L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 |
| C、c(Mg2+)为0.11 mol?L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 |
| D、将0.001 mol?L-1的AgNO3溶液滴入0.001 mol?L-1的KCl和0.001 mol?L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀 |
关于晶体的结构和性质的说法中正确的是( )
| A、晶体和非晶体的区别,就是晶体有自范性,而非晶体没有 |
| B、常温下为气体或者液体的物质,固体时都是分子晶体 |
| C、原子晶体一定是单质元素的原子组成的 |
| D、金属晶体的熔沸点总比分子晶体的熔沸点高 |
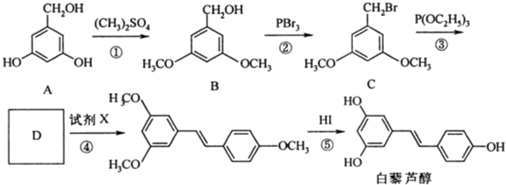
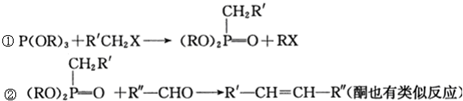
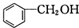 和P(OC2H5)3为原料,选择适当的无机试剂和催化剂,通过合理的途径合成
和P(OC2H5)3为原料,选择适当的无机试剂和催化剂,通过合理的途径合成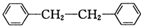 .请补全下列合成路线(含条件、试剂和主要产物的结构简式).
.请补全下列合成路线(含条件、试剂和主要产物的结构简式).