题目内容
关于晶体的结构和性质的说法中正确的是( )
| A、晶体和非晶体的区别,就是晶体有自范性,而非晶体没有 |
| B、常温下为气体或者液体的物质,固体时都是分子晶体 |
| C、原子晶体一定是单质元素的原子组成的 |
| D、金属晶体的熔沸点总比分子晶体的熔沸点高 |
考点:晶体的类型与物质熔点、硬度、导电性等的关系,离子晶体,分子晶体
专题:
分析:A.晶体有自范性,而非晶体没有,晶体内部排列有规则,而非晶体则没有;
B.常温下为气体或者液体的物质,固体时不一定都是分子晶体;
C.相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体叫做原子晶体;
D.一般来说,金属晶体的熔沸点大于分子晶体,但也有特例;
B.常温下为气体或者液体的物质,固体时不一定都是分子晶体;
C.相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体叫做原子晶体;
D.一般来说,金属晶体的熔沸点大于分子晶体,但也有特例;
解答:
解:A.晶体的规则几何外形是自发形成的,有些固体尽管有规则的几何外形,但由于不是自发形成的,所以不属于晶体,所以晶体具有自范性,非晶体没有自范性,故A正确;
B.金属汞是液体,固体时是金属晶体,故B错误;
C.常见的原子晶体是周期系第ⅣA族元素的一些单质和某些化合物,例如金刚石、硅晶体、SiO2、SiC等,故C错误;
D.金属晶体的熔沸点不一定比分子晶体高,如分子晶体硫为固体,金属汞是液体,故D错误;
故选A.
B.金属汞是液体,固体时是金属晶体,故B错误;
C.常见的原子晶体是周期系第ⅣA族元素的一些单质和某些化合物,例如金刚石、硅晶体、SiO2、SiC等,故C错误;
D.金属晶体的熔沸点不一定比分子晶体高,如分子晶体硫为固体,金属汞是液体,故D错误;
故选A.
点评:本题考查晶体的结构和性质的判断,题目难度不大,注意晶体类型的与性质.注意常温下金属汞是液体,但金属汞是金属晶体.

练习册系列答案
相关题目
下列叙述中,正确的是( )
| A、硅化学性质很稳定,因此硅在自然界中以游离态形式存在 |
| B、实验结束后,将废液倒入下水道排出实验室,以免污染实验室 |
| C、实验室盛装NaOH溶液的试剂瓶要用橡皮塞而不用玻璃塞 |
| D、向待测液先滴加新制氯水再滴加KSCN溶液,溶液变成血红色,说明待测液中一定有Fe2+ |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O═CH3COOH+4H+.下列有关说法正确的是( )
| A、检测时,电解质溶液中的H+向负极移动 |
| B、电池反应的化学方程式为CH3CH2OH+O2═CH3COOH+H2O |
| C、正极上发生的反应为:O2+4e-+2H2O═4OH- |
| D、若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气 |
在0.1mol?L-1氨水中加入少量的NH4Cl晶体,则溶液的pH( )
| A、变大 | B、变小 |
| C、不变 | D、无法确定 |
如表为截取的元素周期表前4周期的一部分,且X、Y、Z、R和W均为主族元素.下列说法正确的是( )
| X | ||
| Y | Z | R |
| W |
| A、五种元素的原子最外层电子数一定都大于2 |
| B、X、Z原子序数可能相差18 |
| C、Z可能是氯元素 |
| D、Z的氧化物与X单质不可能发生置换反应 |
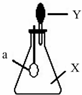 如图,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体 Y滴入瓶中,振荡,过一会可见小气球a鼓起.气体X和液体Y不可能是( )
如图,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体 Y滴入瓶中,振荡,过一会可见小气球a鼓起.气体X和液体Y不可能是( )| A、X是NH3,Y是水 |
| B、X是CO2,Y是稀硫酸 |
| C、X是SO2,Y是NaOH浓溶液 |
| D、X是 HCl,Y是NaNO3 稀溶液 |
将蔗糖用少量水湿润后,一边搅拌一边加入浓硫酸.可以看到蔗糖颜色逐渐变黑,体积不断膨胀,最后变成多孔疏松固体.上述过程中,体现出浓硫酸( )
| A、只有吸水性 |
| B、只有脱水性 |
| C、既有吸水性.又有脱水性 |
| D、有脱水性、吸水性、氧化性 |