题目内容
(1)①常温下,某溶液中由水电离出的c (OH-)=1.0×10-10mol/L,该溶液可以是 .(填选项)
A.pH=4的醋酸 B.pH=10的NaOH溶液 C.pH=9的Na2CO3溶液
D.pH=2的硫酸 E.pH=4的NH4Cl溶液
(2)在100℃时,将100mL 0.1mol/L的稀H2SO4溶液与100mL 0.4mol/L的NaOH溶液混合后,溶液的pH= .(混合时溶液体积变化忽略不计)
(3)常温下,a mL 0.1mol/L盐酸与b mL 0.1mol/L氨水混合,充分反应.若混合后溶液呈中性,则a b(填“<”、“=”或“>”).
(4)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应.若a=b,则反应后溶液中离子浓度从大到小的顺序是 .
(5)氯化铝水溶液呈酸性,原因是(用离子方程式表示): .把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 .
(6)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 .已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20.
A.pH=4的醋酸 B.pH=10的NaOH溶液 C.pH=9的Na2CO3溶液
D.pH=2的硫酸 E.pH=4的NH4Cl溶液
(2)在100℃时,将100mL 0.1mol/L的稀H2SO4溶液与100mL 0.4mol/L的NaOH溶液混合后,溶液的pH=
(3)常温下,a mL 0.1mol/L盐酸与b mL 0.1mol/L氨水混合,充分反应.若混合后溶液呈中性,则a
(4)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应.若a=b,则反应后溶液中离子浓度从大到小的顺序是
(5)氯化铝水溶液呈酸性,原因是(用离子方程式表示):
(6)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
考点:酸碱混合时的定性判断及有关ph的计算,水的电离,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:(1)Kw是水的离子积常数,常温下,Kw=c(H+)×c(OH-)═1×10-14,水电离出的c(H+)=c(OH-)═1×10-7mol/L;常温下,某溶液中由水电离出来的c(H+)=1.0×10-10mol?L-1,说明水的电离被抑制;酸碱对水的电离抑制作用,水解的盐促进水的电离;据此解答即可.
(2)根据硫酸中氢离子与氢氧化钠中氢氧根离子的物质的量判断过量,然后计算出反应后溶液中氢离子浓度,最后计算出其余的pH;
(3)根据NH4Cl溶液呈酸性可知,要使混合后呈中性,必须氢氧化钠过量;根据电荷守恒来分析;
(4)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应.若a=b,反应后一水合氨又电离出氢氧根离子,溶液呈碱性;
(5)氯化铝水溶液呈酸性是因为铝离子水解显酸性;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是水解生成的氢氧化铝分解得到的氧化铝;
(6)难溶电解质的溶度积越小,加入氨水时越易生成沉淀.
(2)根据硫酸中氢离子与氢氧化钠中氢氧根离子的物质的量判断过量,然后计算出反应后溶液中氢离子浓度,最后计算出其余的pH;
(3)根据NH4Cl溶液呈酸性可知,要使混合后呈中性,必须氢氧化钠过量;根据电荷守恒来分析;
(4)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应.若a=b,反应后一水合氨又电离出氢氧根离子,溶液呈碱性;
(5)氯化铝水溶液呈酸性是因为铝离子水解显酸性;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是水解生成的氢氧化铝分解得到的氧化铝;
(6)难溶电解质的溶度积越小,加入氨水时越易生成沉淀.
解答:
解:(1)常温下,由水电离的c(H+)=c(OH-)═1×10-7mol/L>1×10-10mol?L-1,说明该溶液中水的电离受到抑制;
A.pH=4的醋酸抑制水电离,c(H+)=10-4mol/L,c (OH-)=1.0×10-10mol/L,故A符合;
B.pH=10的NaOH溶液抑制水电离,c(H+)=c (OH-)=1.0×10-10mol/L,故B符合;
C.pH=9的Na2CO3溶液中碳酸根离子水解促进水的电离,故C不符合;
D.pH=2的硫酸抑制水电离,c(H+)=10-2mol/L c(OH-)=10-12mol/L,故 D不符合;
E.pH=4的NH4Cl溶液中铵根离子水解促进水的电离,故E不符合;
故答案为:AB;
(2)100mL 0.1mol?L-1的稀H2SO4溶液中氢离子的物质的量为:0.1mol/L×2×0.1L=0.02mol,
100mL 0.4mol?L-1的NaOH溶液中氢氧根离子的物质的量为:0.4mol/L×0.1mol=0.04mol,
两溶液混合后氢氧根离子过量,反应后氢氧根离子的浓度为:
=0.1mol/L,
根据水的离子积常数Kw=10-12可得,溶液中氢离子浓度为:
=10-11mol/L,该溶液的pH=11,
故答案为:11;
(3)根据NH4Cl溶液呈酸性可知,要使混合后呈中性,必须氢氧化钠过量;根据电荷守恒来分析,a<b;
故答案为:<;
(4)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应.若a=b,反应后一水合氨又电离出氢氧根离子,溶液呈碱性,溶液中电荷守恒分析,离子浓度的关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(5)氯化铝水溶液呈酸性是因为铝离子水解显酸性;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是水解生成的氢氧化铝分解得到的氧化铝;
故答案为:Al3++3H2O?Al(OH)3+3H+,Al2O3;
( 6 ) 难溶电解质的溶度积越小,加入氨水时越易生成沉淀,则生成的沉淀为Cu(OH)2,反应的离子方程式为Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,
故答案为:Cu(OH)2;Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+;
A.pH=4的醋酸抑制水电离,c(H+)=10-4mol/L,c (OH-)=1.0×10-10mol/L,故A符合;
B.pH=10的NaOH溶液抑制水电离,c(H+)=c (OH-)=1.0×10-10mol/L,故B符合;
C.pH=9的Na2CO3溶液中碳酸根离子水解促进水的电离,故C不符合;
D.pH=2的硫酸抑制水电离,c(H+)=10-2mol/L c(OH-)=10-12mol/L,故 D不符合;
E.pH=4的NH4Cl溶液中铵根离子水解促进水的电离,故E不符合;
故答案为:AB;
(2)100mL 0.1mol?L-1的稀H2SO4溶液中氢离子的物质的量为:0.1mol/L×2×0.1L=0.02mol,
100mL 0.4mol?L-1的NaOH溶液中氢氧根离子的物质的量为:0.4mol/L×0.1mol=0.04mol,
两溶液混合后氢氧根离子过量,反应后氢氧根离子的浓度为:
| 0.04mol-0.02mol |
| 0.2L |
根据水的离子积常数Kw=10-12可得,溶液中氢离子浓度为:
| 10-12 |
| 0.1 |
故答案为:11;
(3)根据NH4Cl溶液呈酸性可知,要使混合后呈中性,必须氢氧化钠过量;根据电荷守恒来分析,a<b;
故答案为:<;
(4)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应.若a=b,反应后一水合氨又电离出氢氧根离子,溶液呈碱性,溶液中电荷守恒分析,离子浓度的关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(5)氯化铝水溶液呈酸性是因为铝离子水解显酸性;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是水解生成的氢氧化铝分解得到的氧化铝;
故答案为:Al3++3H2O?Al(OH)3+3H+,Al2O3;
( 6 ) 难溶电解质的溶度积越小,加入氨水时越易生成沉淀,则生成的沉淀为Cu(OH)2,反应的离子方程式为Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,
故答案为:Cu(OH)2;Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+;
点评:本题考查了酸碱反应后溶液酸碱性分析判断,离子浓度大小比较,盐类水解,溶度积常数的计算分析,影响水电离的因素分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关化学用语的表述正确的是( )
A、 名称是3-甲基-1,3-丁二烯 名称是3-甲基-1,3-丁二烯 |
B、 名称是2-羟基丁烷 名称是2-羟基丁烷 |
| C、二氧化碳的结构式:O=C=O |
D、乙烯的球棍模型: |
如表为截取的元素周期表前4周期的一部分,且X、Y、Z、R和W均为主族元素.下列说法正确的是( )
| X | ||
| Y | Z | R |
| W |
| A、五种元素的原子最外层电子数一定都大于2 |
| B、X、Z原子序数可能相差18 |
| C、Z可能是氯元素 |
| D、Z的氧化物与X单质不可能发生置换反应 |
下列关于物质的作用和性质的说法不正确的是( )
| A、盛有被KCl饱和溶液浸泡过的琼脂的U型管,可用作原电池的盐桥 |
| B、Al3+能水解为Al(OH)3胶体,明矾可用作净水剂 |
| C、碳酸钠溶液显碱性,常用来制胃酸 |
| D、在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
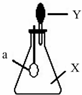 如图,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体 Y滴入瓶中,振荡,过一会可见小气球a鼓起.气体X和液体Y不可能是( )
如图,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体 Y滴入瓶中,振荡,过一会可见小气球a鼓起.气体X和液体Y不可能是( )| A、X是NH3,Y是水 |
| B、X是CO2,Y是稀硫酸 |
| C、X是SO2,Y是NaOH浓溶液 |
| D、X是 HCl,Y是NaNO3 稀溶液 |
下列做法中不正确的是( )
| A、做喷泉实验来验证氨气极易溶解于水的性质 |
| B、金属钠着火时不可以用泡沫灭火器,可用干燥的沙土灭火 |
| C、用NaOH溶液除去混在CO2气体中的HCl |
| D、实验室中保存FeSO4溶液,应向其中加入铁粉 |
下列对于某些离子的检验及结论正确的是( )
| A、某溶液中加入稀盐酸产生无色气体,将产生的气体通入澄清石灰水,石灰水变浑浊,则该溶液中一定含有CO32一 |
| B、某溶液中加入氢氧化钠溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,则该溶液中一定含有NH4+ |
| C、某溶液中滴入BaCl2溶液,再滴加稀盐酸,产生白色沉淀,则一定含有SO42一 |
| D、某溶液加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则一定含有Ba2+ |