题目内容
13. X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:
X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:(1)Y元素原子的结构示意图为
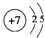 .
.(2)元素的金属性J>W(填“>”或“<”),下列各项中,能说明这一结论的事实有ACD(填序号)
A.单质与酸反应置换出氢气的难易程度 B.单质的熔点
C.最高价氧化物对应水化物的碱性强弱 D.在金属活动顺序表中的位置
(3)已知:①3W(s)+2Z2(g)=W3Z4(s)△H1=-1118.4kJ/mol
②2X2(g)+Z2(g)=2X2Z(g)△H2=-483.8kJ/mol
则反应3W(s)+4X2Z(g)=W3Z4(s)+4X2(g)的△H=-150.8kJ/mol.
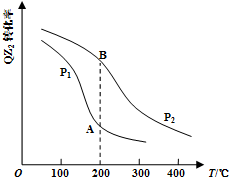
(4)已知反应:2QZ2(g)+Z2(g)?2QZ3(g),QZ2的平衡转化率与温度、压强的关系如图所示:
①压强:P1<P2(填“>”、“=”或“<”).
②200℃下,将一定量的QZ2和Z2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
| 气体 | QZ2 | Z2 | QZ3 |
| 浓度(mol/L) | 0.4 | 1.2 | 1.6 |
a.反应速率v(QZ2)=v(QZ3)
b.体系的压强保持不变
c.混合气体的密度保持不变
d.QZ2和Z2的体积比保持不变
计算上述反应在0~10min内,v(QZ2)=0.16mol/(L.min).
(5)以YX3为燃料可以设计成燃料电池(电极材料均为惰性电极,KOH溶液作电解质溶液)该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O.
分析 X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,则Z为Na;J元素的焰色反应呈黄色,则J为Na;Q的最外层电子数与其电子总数比为3:8,原子序数大于Na,处于第三周期,设最外层电子数为a,则a:(2+8+a)=3:8,解得a=6,故Q为S元素;X能与J形成离子化合物,且J+的半径大于X-的半径,则X为H元素;Y原子序数小于钠,处于第二周期,而Y的氧化物是形成酸雨的主要物质之一,故Y为N元素;W是应用最广泛的金属元素,则W为Fe,据此解答.
(1)Y为N元素,原子核外有7个电子,有2个电子层,各层电子数为2、5;
(2)根据金属活动顺序表、金属单质与水或酸反应剧烈程度、难易程度,最高价氧化物对应水化物的碱性强弱等判断金属性强弱;
(3)已知:①3W(s)+2Z2(g)=W3Z4(s)△H1=-1118.4kJ/mol
②2X2(g)+Z2(g)=2X2Z(g)△H2=-483.8kJ/mol
根据盖斯定律,①-②×2可得:3W(s)+4X2Z(g)=W3Z4(s)+4X2(g;
(4)①正反应为气体体积减小的反应,温度一定时,增大压强平衡正向移动,QZ2(g)的转化率增大;
②可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量由方程式可知,△c(QZ2)=△c(QZ3)=1.6mol/L,再根据v=$\frac{△c}{△t}$计算v(QZ2);
(5)以NH3为燃料设计成燃料电池,电极材料均为惰性电极,KOH溶液作电解质溶液,原电池负极发生氧化反应,氨气在负极失去电子,碱性条件下可以得到氮气与水.
解答 解:X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,则Z为Na;J元素的焰色反应呈黄色,则J为Na;Q的最外层电子数与其电子总数比为3:8,原子序数大于Na,处于第三周期,设最外层电子数为a,则a:(2+8+a)=3:8,解得a=6,故Q为S元素;X能与J形成离子化合物,且J+的半径大于X-的半径,则X为H元素;Y原子序数小于钠,处于第二周期,而Y的氧化物是形成酸雨的主要物质之一,故Y为N元素;W是应用最广泛的金属元素,则W为Fe.
(1)Y为N元素,原子的结构示意图为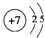 ,故答案为:
,故答案为: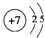 ;
;
(2)元素的金属性Na>Fe,
A.金属单质与酸反应生成氢气越容易,其金属性越强,故A正确;
B.单质的熔点属于物理性质,不能比较金属性强弱,故B错误
C.最高价氧化物对应水化物的碱性越强,元素金属性越强,故C正确;
D.根据在金属活动顺序表中的位置,可以判断金属性强弱,故D正确,
故选:ACD;
(3)已知:①3W(s)+2Z2(g)=W3Z4(s)△H1=-1118.4kJ/mol
②2X2(g)+Z2(g)=2X2Z(g)△H2=-483.8kJ/mol
根据盖斯定律,①-②×2可得:3W(s)+4X2Z(g)=W3Z4(s)+4X2(g),则△H=-1118.4kJ/mol-2(-483.8kJ/mol)=-150.8kJ/mol,
故答案为:-150.8kJ/mol;
(4)①由图可知,温度一定,压强P1时QZ2(g)的转化率较小,正反应为气体体积减小的反应,温度一定时,增大压强平衡正向移动,QZ2(g)的转化率增大,故压强P1<P2,
故答案为:<;
②a.反应速率v(QZ2)=v(QZ3),未指明正逆速率,不能说明到达平衡,若分别表示正、逆速率时反应到达平衡,故a错误;
b.随反应进行气体物质的量减小,恒温恒容下,压强减小,当体系的压强保持不变时,说明到达平衡,故b正确;
c.混合气体总质量不变,容器容积不变,混合气体的密度为定值,始终保持不变,故c错误;
d.QZ2和Z2按物质的量1:3混合,二者氨气2:1反应,随反应进行二者体积之比发生变化,当二者体积比保持不变时,反应到达平衡状态,故d正确;
由方程式可知,△c(QZ2)=△c(QZ3)=1.6mol/L,故0~10min内,v(QZ2)=$\frac{1.6mol/L}{10min}$=0.16mol/(L.min),
故答案为:bd;0.16mol/(L.min);
(5)以NH3为燃料设计成燃料电池,电极材料均为惰性电极,KOH溶液作电解质溶液,原电池负极发生氧化反应,氨气在负极失去电子,碱性条件下可以得到氮气与水,该电池负极电极反应式为:2NH3-6e-+6OH-=N2+6H2O,
故答案为:2NH3-6e-+6OH-=N2+6H2O.
点评 本题考查结构性质位置关系应用、盖斯定律应用、化学平衡计算与影响因素、平衡状态判断、化学平衡图象、原电池等,注意掌握金属性、非金属强弱比较实验事实.

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 2014 年西非国家爆发了埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| C. | 金属着火时,可用细沙覆盖灭火;电器设备引起的火灾,不可用泡沫灭火器灭火 | |
| D. | 在4mL0.1mol•L-1的K2Cr2O7溶液中滴加数滴1mol•L-1的NaOH溶液,溶液颜色从橙色变成黄色 |
| A. | 50 kJ/mol | B. | 3900 kJ/mol | C. | 1300 kJ/mol | D. | 450 kJ/mol |
| A. | $\frac{3}{4}$dm3 | B. | $\frac{1}{2}$dm3 | C. | $\frac{1}{4}$dm3 | D. | 全满 |
| A. | 烧碱溶液中加入铝片:Al+4OH-═AlO2-+2H2O | |
| B. | 澄清石灰水与足量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| D. | 向NaAlO2溶液中通入少量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |


