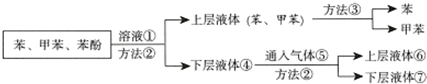
题目内容
5.一定条件下,燃烧1g乙炔(C2H2)气体,生成液态水和二氧化碳,放出50kJ热量,则该条件下乙炔的燃烧热为( )| A. | 50 kJ/mol | B. | 3900 kJ/mol | C. | 1300 kJ/mol | D. | 450 kJ/mol |
分析 已知燃烧1g乙炔物质的量n=$\frac{m}{M}$=$\frac{1g}{26g/mol}$=$\frac{1}{26}$mol,反应生成二氧化碳气体和液态水时,放出50kJ热量,而燃烧热是在101kp时1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,据此分析.
解答 解:燃烧热是在101kp时1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,而燃烧1g乙炔物质的量n=$\frac{m}{M}$=$\frac{1g}{26g/mol}$=$\frac{1}{26}$mol,反应生成二氧化碳气体和液态水时,放出50kJ热量,故燃烧1mol乙炔生成二氧化碳气体和液态水时,放出热量为50kJ×26=1300KJ,故选C.
点评 本题考查反应热的计算,明确物质的量与热量的关系式解答的关键,题目难度不大.

练习册系列答案
相关题目
16.25℃时加水稀释10mL pH=11的氨水,下列叙述正确的是( )
| A. | 原氨水的浓度为10-3 mol•L-1 | |
| B. | 溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| C. | 氨水的电离程度增大,溶液中所有离子的浓度均减小 | |
| D. | 再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定等于7 |
13. X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:
X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:
(1)Y元素原子的结构示意图为 .
.
(2)元素的金属性J>W(填“>”或“<”),下列各项中,能说明这一结论的事实有ACD(填序号)
A.单质与酸反应置换出氢气的难易程度 B.单质的熔点
C.最高价氧化物对应水化物的碱性强弱 D.在金属活动顺序表中的位置
(3)已知:①3W(s)+2Z2(g)=W3Z4(s)△H1=-1118.4kJ/mol
②2X2(g)+Z2(g)=2X2Z(g)△H2=-483.8kJ/mol
则反应3W(s)+4X2Z(g)=W3Z4(s)+4X2(g)的△H=-150.8kJ/mol.
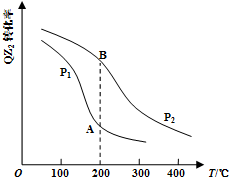
(4)已知反应:2QZ2(g)+Z2(g)?2QZ3(g),QZ2的平衡转化率与温度、压强的关系如图所示:
①压强:P1<P2(填“>”、“=”或“<”).
②200℃下,将一定量的QZ2和Z2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
能说明该反应达到化学平衡状态的是bd.
a.反应速率v(QZ2)=v(QZ3)
b.体系的压强保持不变
c.混合气体的密度保持不变
d.QZ2和Z2的体积比保持不变
计算上述反应在0~10min内,v(QZ2)=0.16mol/(L.min).
(5)以YX3为燃料可以设计成燃料电池(电极材料均为惰性电极,KOH溶液作电解质溶液)该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O.
 X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:
X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:(1)Y元素原子的结构示意图为
 .
.(2)元素的金属性J>W(填“>”或“<”),下列各项中,能说明这一结论的事实有ACD(填序号)
A.单质与酸反应置换出氢气的难易程度 B.单质的熔点
C.最高价氧化物对应水化物的碱性强弱 D.在金属活动顺序表中的位置
(3)已知:①3W(s)+2Z2(g)=W3Z4(s)△H1=-1118.4kJ/mol
②2X2(g)+Z2(g)=2X2Z(g)△H2=-483.8kJ/mol
则反应3W(s)+4X2Z(g)=W3Z4(s)+4X2(g)的△H=-150.8kJ/mol.
(4)已知反应:2QZ2(g)+Z2(g)?2QZ3(g),QZ2的平衡转化率与温度、压强的关系如图所示:
①压强:P1<P2(填“>”、“=”或“<”).
②200℃下,将一定量的QZ2和Z2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
| 气体 | QZ2 | Z2 | QZ3 |
| 浓度(mol/L) | 0.4 | 1.2 | 1.6 |
a.反应速率v(QZ2)=v(QZ3)
b.体系的压强保持不变
c.混合气体的密度保持不变
d.QZ2和Z2的体积比保持不变
计算上述反应在0~10min内,v(QZ2)=0.16mol/(L.min).
(5)以YX3为燃料可以设计成燃料电池(电极材料均为惰性电极,KOH溶液作电解质溶液)该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O.
20.下列关于Na2CO3固体和NaHCO3固体性质的有关叙述中正确的是( )
| A. | 在水中溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3<NaHCO3 | |
| C. | 与相同浓度的盐酸反应的速度:Na2CO3>NaHCO3 | |
| D. | Na2CO3与NaHCO3相互转化的反应是可逆反应 |
10.下列说法正确的是( )
| A. | 离子化合物中只能含离子键,不能有共价键 | |
| B. | 所有非金属之间形成的化学键一定是共价键 | |
| C. | 电子数相同的两种微粒一定是同一元素 | |
| D. | 化学变化一定有化学键的断裂和形成 |