题目内容
1.目前,新能源不断被利用到现代的汽车中,高铁电池技术就是科研机构着力研究的一个方向.(1)高铁酸钾-锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是Zn(填化学式).
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中性和酸性条件下不稳定.反应原理为
Ⅰ.在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4:3NaClO+2Fe(NO3)3+10NaOH═2Na2FeO4↓+3NaCl+6NaNO3+5H2O.
Ⅱ.Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH═K2FeO4+2NaOH.
主要的生产流程如图1:

①写出反应①的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
②流程图中反应③是在某低温下进行的,且此温度无NaOH析出,说明此温度下
Ksp(K2FeO4)<Ksp(Na2FeO4)(填“>”、“<”或“=”).
(3)已知K2FeO4在水溶液中可以发生:4FeO${\;}_{4}^{2-}$+10H2O?4Fe(OH)3↓+8OH-+3O2↑,则K2FeO4在水处理中的作用是杀菌消毒、净水.
(4)FeO${\;}_{4}^{2-}$在水溶液中的存在形态如图2所示.
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO${\;}_{4}^{-}$的分布分数的变化情况是先变大,后变小.
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,HFeO4-转化为FeO42-(填化学式).
分析 (1)高铁酸钾-锌电池(碱性介质)中,高铁酸钾是氧化剂在正极反应,锌易失电子是还原剂发生氧化反应而作负极,据此答题;
(2)①氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
②相同温度下,溶度积大的物质向溶度积小的物质转化;
(3)高铁酸钠具有强氧化性,被还原后生成氢氧化铁胶体,氢氧化铁胶体具有吸附性;
(4)①根据图象可知随着溶液碱性的增强,HFeO4-的分布分数先增大后减小;
②向pH=6的这种溶液中滴加KOH溶液,根据图象知,随着溶液碱性的增强,FeO42-的分布分数逐渐增大,HFeO4-的分布分数逐渐减小.
解答 解:(1)高铁酸钾-锌电池(碱性介质)中,高铁酸钾是氧化剂在正极反应,锌易失电子是还原剂发生氧化反应而作负极,
故答案为:Zn;
(2)①氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
②相同温度下,溶度积大的物质向溶度积小的物质转化,所以Ksp(K2FeO4)<Ksp(Na2FeO4),
故答案为:<;
(3)高铁酸钠具有强氧化性,所以能杀菌消毒,被还原后生成氢氧化铁胶体,氢氧化铁胶体具有吸附性,所以能净水,
故答案为:杀菌消毒、净水;
(4)①根据图象知,随着溶液碱性的增强,HFeO4-的分布分数先增大后减小,
故答案为:先变大,后变小;
②根据图象知,随着溶液碱性的增强,FeO42-的分布分数逐渐增大,HFeO4-的分布分数逐渐减小,所以HFeO4-转化为FeO42-,
故答案为:HFeO4-;FeO42-.
点评 本题考查原电池原理、难溶电解质的溶解平衡等知识点,难度不大,注意基础知识的积累、运用.

练习册系列答案
相关题目
11.下列措施对增大反应速率明显有效的是( )
| A. | 在K2SO4与BaCl2两溶液反应时,增大压强 | |
| B. | 碱金属Cs与水反应时增大水的用量 | |
| C. | Fe与稀硫酸反应制取氢气时,改用浓硫酸 | |
| D. | Al与盐酸反应,加几滴氯化铜溶液 |
9.下列物质属纯净物的是( )
| A. | 汽油 | B. | 纯植物油 | C. | 蔗糖 | D. | 聚乙烯 |
16.25℃时加水稀释10mL pH=11的氨水,下列叙述正确的是( )
| A. | 原氨水的浓度为10-3 mol•L-1 | |
| B. | 溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| C. | 氨水的电离程度增大,溶液中所有离子的浓度均减小 | |
| D. | 再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定等于7 |
6.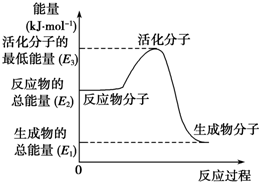 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H1=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H2=-192.9kJ•mol-1
下列说法正确的是( )
 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H1=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H2=-192.9kJ•mol-1
下列说法正确的是( )
| A. | 上述图示的反应为吸热反应 | |
| B. | 图中的能量变化如图所示,则△H=E1-E3 | |
| C. | H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收热量 | |
| D. | 根据①②推知:在25℃、101 kPa时,1 mol CH3OH(g)完全燃烧生成CO2和H2O放出的热量应大于676.7 kJ |
13. X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:
X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:
(1)Y元素原子的结构示意图为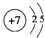 .
.
(2)元素的金属性J>W(填“>”或“<”),下列各项中,能说明这一结论的事实有ACD(填序号)
A.单质与酸反应置换出氢气的难易程度 B.单质的熔点
C.最高价氧化物对应水化物的碱性强弱 D.在金属活动顺序表中的位置
(3)已知:①3W(s)+2Z2(g)=W3Z4(s)△H1=-1118.4kJ/mol
②2X2(g)+Z2(g)=2X2Z(g)△H2=-483.8kJ/mol
则反应3W(s)+4X2Z(g)=W3Z4(s)+4X2(g)的△H=-150.8kJ/mol.
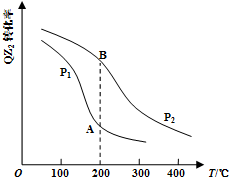
(4)已知反应:2QZ2(g)+Z2(g)?2QZ3(g),QZ2的平衡转化率与温度、压强的关系如图所示:
①压强:P1<P2(填“>”、“=”或“<”).
②200℃下,将一定量的QZ2和Z2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
能说明该反应达到化学平衡状态的是bd.
a.反应速率v(QZ2)=v(QZ3)
b.体系的压强保持不变
c.混合气体的密度保持不变
d.QZ2和Z2的体积比保持不变
计算上述反应在0~10min内,v(QZ2)=0.16mol/(L.min).
(5)以YX3为燃料可以设计成燃料电池(电极材料均为惰性电极,KOH溶液作电解质溶液)该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O.
 X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:
X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:(1)Y元素原子的结构示意图为
 .
.(2)元素的金属性J>W(填“>”或“<”),下列各项中,能说明这一结论的事实有ACD(填序号)
A.单质与酸反应置换出氢气的难易程度 B.单质的熔点
C.最高价氧化物对应水化物的碱性强弱 D.在金属活动顺序表中的位置
(3)已知:①3W(s)+2Z2(g)=W3Z4(s)△H1=-1118.4kJ/mol
②2X2(g)+Z2(g)=2X2Z(g)△H2=-483.8kJ/mol
则反应3W(s)+4X2Z(g)=W3Z4(s)+4X2(g)的△H=-150.8kJ/mol.
(4)已知反应:2QZ2(g)+Z2(g)?2QZ3(g),QZ2的平衡转化率与温度、压强的关系如图所示:
①压强:P1<P2(填“>”、“=”或“<”).
②200℃下,将一定量的QZ2和Z2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
| 气体 | QZ2 | Z2 | QZ3 |
| 浓度(mol/L) | 0.4 | 1.2 | 1.6 |
a.反应速率v(QZ2)=v(QZ3)
b.体系的压强保持不变
c.混合气体的密度保持不变
d.QZ2和Z2的体积比保持不变
计算上述反应在0~10min内,v(QZ2)=0.16mol/(L.min).
(5)以YX3为燃料可以设计成燃料电池(电极材料均为惰性电极,KOH溶液作电解质溶液)该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O.
10.下列说法正确的是( )
| A. | 离子化合物中只能含离子键,不能有共价键 | |
| B. | 所有非金属之间形成的化学键一定是共价键 | |
| C. | 电子数相同的两种微粒一定是同一元素 | |
| D. | 化学变化一定有化学键的断裂和形成 |