题目内容
2.体积为1dm3的干燥烧瓶用排空气法冲入氨气后,测得烧瓶中气体对氧气的相对密度为0.625,用此气体进行喷泉实验,当喷泉停止后,进入烧瓶中液体的体积为( )| A. | $\frac{3}{4}$dm3 | B. | $\frac{1}{2}$dm3 | C. | $\frac{1}{4}$dm3 | D. | 全满 |
分析 容器中的气体相对氧气的密度为0.625,则气体的平均相对分子质量为0.625×32=20,设氨气的体积分数为x,则空气的体积分数为(1-x),根据平均相对分子质量计算x的值,进而计算氨气的体积,氨气的体积即为进入容器中液体的体积.
解答 解:容器中的气体相对氧气的密度为0.625,则气体的平均相对分子质量为0.625×32=20,
设氨气的体积分数为x,则空气的体积分数为(1-x),则:
17x+29(1-x)=20,
解得:x=0.75,
故氨气的体积为1dm3×0.75=0.75dm3,
即为进入容器中液体的体积0.75dm3,
故选A.
点评 本题考查阿伏伽德罗定律及推论、化学计算等,难度中等,根据平均相对分子质量计算HCl的体积分数是关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
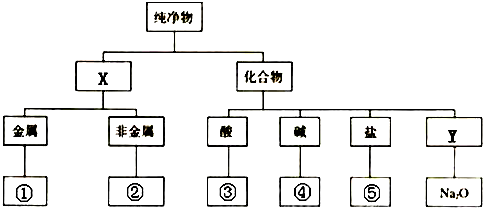
13. X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:
X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:
(1)Y元素原子的结构示意图为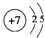 .
.
(2)元素的金属性J>W(填“>”或“<”),下列各项中,能说明这一结论的事实有ACD(填序号)
A.单质与酸反应置换出氢气的难易程度 B.单质的熔点
C.最高价氧化物对应水化物的碱性强弱 D.在金属活动顺序表中的位置
(3)已知:①3W(s)+2Z2(g)=W3Z4(s)△H1=-1118.4kJ/mol
②2X2(g)+Z2(g)=2X2Z(g)△H2=-483.8kJ/mol
则反应3W(s)+4X2Z(g)=W3Z4(s)+4X2(g)的△H=-150.8kJ/mol.
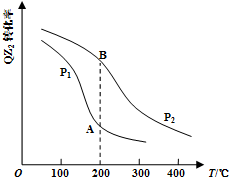
(4)已知反应:2QZ2(g)+Z2(g)?2QZ3(g),QZ2的平衡转化率与温度、压强的关系如图所示:
①压强:P1<P2(填“>”、“=”或“<”).
②200℃下,将一定量的QZ2和Z2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
能说明该反应达到化学平衡状态的是bd.
a.反应速率v(QZ2)=v(QZ3)
b.体系的压强保持不变
c.混合气体的密度保持不变
d.QZ2和Z2的体积比保持不变
计算上述反应在0~10min内,v(QZ2)=0.16mol/(L.min).
(5)以YX3为燃料可以设计成燃料电池(电极材料均为惰性电极,KOH溶液作电解质溶液)该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O.
 X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:
X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:(1)Y元素原子的结构示意图为
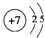 .
.(2)元素的金属性J>W(填“>”或“<”),下列各项中,能说明这一结论的事实有ACD(填序号)
A.单质与酸反应置换出氢气的难易程度 B.单质的熔点
C.最高价氧化物对应水化物的碱性强弱 D.在金属活动顺序表中的位置
(3)已知:①3W(s)+2Z2(g)=W3Z4(s)△H1=-1118.4kJ/mol
②2X2(g)+Z2(g)=2X2Z(g)△H2=-483.8kJ/mol
则反应3W(s)+4X2Z(g)=W3Z4(s)+4X2(g)的△H=-150.8kJ/mol.
(4)已知反应:2QZ2(g)+Z2(g)?2QZ3(g),QZ2的平衡转化率与温度、压强的关系如图所示:
①压强:P1<P2(填“>”、“=”或“<”).
②200℃下,将一定量的QZ2和Z2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
| 气体 | QZ2 | Z2 | QZ3 |
| 浓度(mol/L) | 0.4 | 1.2 | 1.6 |
a.反应速率v(QZ2)=v(QZ3)
b.体系的压强保持不变
c.混合气体的密度保持不变
d.QZ2和Z2的体积比保持不变
计算上述反应在0~10min内,v(QZ2)=0.16mol/(L.min).
(5)以YX3为燃料可以设计成燃料电池(电极材料均为惰性电极,KOH溶液作电解质溶液)该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O.
10.下列说法正确的是( )
| A. | 离子化合物中只能含离子键,不能有共价键 | |
| B. | 所有非金属之间形成的化学键一定是共价键 | |
| C. | 电子数相同的两种微粒一定是同一元素 | |
| D. | 化学变化一定有化学键的断裂和形成 |
17.在反应2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑中,还原产物是( )
①KMnO4 ②K2MnO4 ③MnO2 ④O2.
①KMnO4 ②K2MnO4 ③MnO2 ④O2.
| A. | ①和② | B. | ②和③ | C. | 只有④ | D. | 只有③ |