题目内容
8.铁及其化合物在生产和生活中有着广泛的应用.(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:

回答下列问题:
①操作Ⅰ、Ⅱ的名称分别是过滤、洗涤.
②写出在空气中煅烧FeCO3的化学方程式4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;
③煅烧如果不充分,产品中将有Fe2+存在,试设计实验检验产品中有无Fe2+.
(2)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定.
a.称取2.850g绿矾(FeSO4•7H2O)产品,配成250mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.010 00mol•L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①写出酸性KMnO4溶液与FeSO4溶液反应的离子方程式MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O.
②计算上述样品中FeSO4•7H2O的质量分数为97.5%[已知M(FeSO4•7H2O)=278g•mol-1]
③滴定达到终点时锥形瓶中溶液颜色变化为溶液由浅绿色变为紫红色,且半分钟内不立即褪去.
④下列操作会导致样品中FeSO4•7H2O的质量分数的测定结果偏高的有bc.
a.未干燥锥形瓶
b.盛装标准液的滴定管没有用标准液润洗
c.滴定结束时仰视刻度线读数
d.量取待测液的滴定管没有润洗.
分析 碳酸钠溶液为碱性溶液,能够除去油污,实验步骤①的目的是洗油污,铁屑溶于稀硫酸温度控制在50~800C,加快反应速率、增大FeSO4的溶解度,由工艺流程可知,操作I是将固体与液体分离,应采取过量的方法,加入稍过量的碳酸氢铵,滤液中含Fe2+,与碳酸氢铵反应Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,生成碳酸亚铁沉淀,操作II为洗涤,然后干燥、灼烧得到氧化铁,
(1)①分离可溶物和不溶物用过滤,除去固体上的少量可溶性杂质用洗涤;
②FeCO3与氧气反应生成三氧化二铁和二氧化碳;
③依据煅烧反应不完全,生成氧化铁中含有碳酸亚铁,可以先加酸溶解,再加入高锰酸钾溶液检验亚铁离子的存在;
(2)①高锰酸钾溶液具有强氧化性,亚铁离子具有还原性,酸性溶液中亚铁离子被高锰酸钾氧化为铁离子,本身被还原为锰离子,结合电荷守恒,原子守恒配平书写;
②依据元素守恒和氧化还原反应计算得到;
③亚铁离子被氧化为三价铁离子,高锰酸钾溶液做指示剂,滴定终点时溶液由浅绿色变为紫红色,且半分钟内不立即褪去;
④依据滴定过程中C(待测)=$\frac{C(标准)V(标准)}{V(待测)}$,操作过程中引起误差需要分析道到标准液的体积变化分析;
解答 解:(1)①分离可溶物和不溶物用过滤,除去固体上的少量可溶性杂质用洗涤,
故答案为:过滤;洗涤;
②在空气中煅烧FeCO3,FeCO3与氧气反应生成三氧化二铁和二氧化碳,反应方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2,
故答案为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;
③煅烧如果不充分,产品中将有Fe2+ 存在,主要是Fe2O3和FeCO3,取样品放入试管中,加入稀硫酸溶解得到溶液,滴入高猛酸钾溶液,若滴入的高锰酸钾溶液褪色证明含有亚铁离子,否则不存在,
故答案为:取固体样品少许放入试管中,加入足量稀硫酸,震荡试管,再加入几滴滴入KMnO4溶液,若溶液褪色证明含有Fe2+,否则不存在;
(2)①高锰酸钾溶液具有强氧化性,亚铁离子具有还原性,酸性溶液中亚铁离子被高锰酸钾氧化为铁离子,本身被还原为锰离子,酸性KMnO4溶液与FeSO4溶液反应的离子方程式:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O,
故答案为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O;
②依据步骤分析,25ml溶液被高锰酸钾溶液滴定反应,终点时消耗亚铁离子物质的量为:
MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O;
1 5
0.0200L×0.0100mol/L n(Fe2+)
n(Fe2+)=0.00100mol;
配制的250ml溶液中含亚铁离子物质的量n=0.01mol;
样品中绿矾的质量分数=$\frac{0.01mol×278g/mol}{2.850}$×100%=97.5%
故答案为:97.5%;
③滴定实验是利用高锰酸钾溶液的颜色变化指示反应终点,所以反应完全后,溶液呈紫红色,
故答案为:溶液由浅绿色变为紫红色,且半分钟内不立即褪去;
④滴定过程中C(待测)=$\frac{C(标准)V(标准)}{V(待测)}$,
a、锥形瓶未干燥对滴定结果无影响,故a不选;
b、盛装标准液的滴定管没有用标准液润洗,高锰酸钾溶液变稀,滴定时消耗溶液体积增大,根据C(待测)=$\frac{C(标准)V(标准)}{V(待测)}$,V标偏大,则c待偏高,故b选;
c、滴定结束时仰视刻度线读数,读出的消耗的高锰酸钾溶液体积偏大,根据C(待测)=$\frac{C(标准)V(标准)}{V(待测)}$,V标偏大,则c待偏高,故c选;
d、量取待测液的滴定管没有润洗,待测液体被稀释,则消耗的标准液体积偏小,根据C(待测)=$\frac{C(标准)V(标准)}{V(待测)}$,V标偏小,则c待偏低,故d不选;
故选bc.
点评 本题考查了铁及其化合物性质的分析应用,滴定实验的操作步骤和注意问题,滴定实验的计算应用,误差分析依据,题目难度中等.

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案| A. | 原氨水的浓度为10-3 mol•L-1 | |
| B. | 溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| C. | 氨水的电离程度增大,溶液中所有离子的浓度均减小 | |
| D. | 再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定等于7 |
 X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:
X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:(1)Y元素原子的结构示意图为
 .
.(2)元素的金属性J>W(填“>”或“<”),下列各项中,能说明这一结论的事实有ACD(填序号)
A.单质与酸反应置换出氢气的难易程度 B.单质的熔点
C.最高价氧化物对应水化物的碱性强弱 D.在金属活动顺序表中的位置
(3)已知:①3W(s)+2Z2(g)=W3Z4(s)△H1=-1118.4kJ/mol
②2X2(g)+Z2(g)=2X2Z(g)△H2=-483.8kJ/mol
则反应3W(s)+4X2Z(g)=W3Z4(s)+4X2(g)的△H=-150.8kJ/mol.
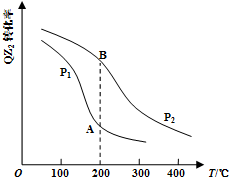
(4)已知反应:2QZ2(g)+Z2(g)?2QZ3(g),QZ2的平衡转化率与温度、压强的关系如图所示:
①压强:P1<P2(填“>”、“=”或“<”).
②200℃下,将一定量的QZ2和Z2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
| 气体 | QZ2 | Z2 | QZ3 |
| 浓度(mol/L) | 0.4 | 1.2 | 1.6 |
a.反应速率v(QZ2)=v(QZ3)
b.体系的压强保持不变
c.混合气体的密度保持不变
d.QZ2和Z2的体积比保持不变
计算上述反应在0~10min内,v(QZ2)=0.16mol/(L.min).
(5)以YX3为燃料可以设计成燃料电池(电极材料均为惰性电极,KOH溶液作电解质溶液)该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O.
| A. | 在水中溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3<NaHCO3 | |
| C. | 与相同浓度的盐酸反应的速度:Na2CO3>NaHCO3 | |
| D. | Na2CO3与NaHCO3相互转化的反应是可逆反应 |
①KMnO4 ②K2MnO4 ③MnO2 ④O2.
| A. | ①和② | B. | ②和③ | C. | 只有④ | D. | 只有③ |
| A. | 胶体的分散质能通过滤纸空隙,而浊液的分散质不能 | |
| B. | 胶体粒子带电荷 | |
| C. | 分散质粒子直径在1 nm~100 nm之间 | |
| D. | 产生丁达尔效应 |
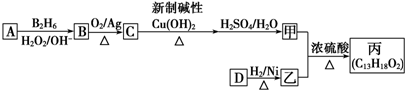
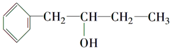 的同系物.
的同系物. .
. ,该反应的类型是取代反应.
,该反应的类型是取代反应.