题目内容
碳酸二甲酯(DRC)是一种新型的汽油添加剂.可由甲醇和二氧化碳在催化剂作用下直接合成DRC:CO2+2CH3OH→CO(OCH3)2+H2O,但甲醇转化率通常很低,这制约了该反应走向工业化应用.某有机化学研究所为了评价催化剂的催化效果,在保持其他条件不变的情况下,研究温度、反应时间、催化剂用量分别对转化数(TON)的影响.计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量.
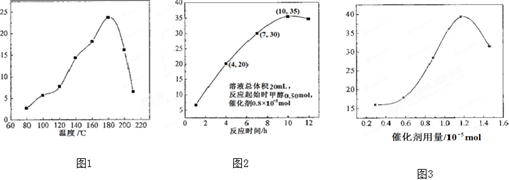
(1)根据图1判断该反应在平衡后升高温度化学平衡的移动方向并说明理由: .
(2)根据图2,已知溶液总体积20没L,反应起始时甲醇为0.50mol,加入的催化剂为0.8×10-5 mol,计算该温度下,4~10h内DRC的平均反应速率: ;计算10h时,甲醇的转化率: .
(3)根据图3,判断下列说法不正确的是 .
A.通过上述反应可以利用易得且价廉的甲醇把温室气体CO2转化为环保添加剂,这在资源循环利用和环境保护方面都具有实际意义
B.在温度、容器体积、催化剂用量一定的已经达到平衡的体系中,
加入二氧化碳气体,将提高该反应的TON
C.当催化剂用量小于1.2×10-5mol时,甲醇的平衡转化率随
着催化剂用量的增加而显著提高
D.当催化剂用量大于1.2×10-5 mol时,DRC的产率随着催化剂用量的增加反而急剧下降
(4)200℃时由甲醇和二氧化碳在催化剂作用下直接合成DRC(此时反应物和生成物均为气体.)的平衡常数表达式为 .若甲醇和DRC的标准燃烧热分别为△H1和△H2,则上述反应在25℃时的焓变△H3= .

(1)根据图1判断该反应在平衡后升高温度化学平衡的移动方向并说明理由:
(2)根据图2,已知溶液总体积20没L,反应起始时甲醇为0.50mol,加入的催化剂为0.8×10-5 mol,计算该温度下,4~10h内DRC的平均反应速率:
(3)根据图3,判断下列说法不正确的是
A.通过上述反应可以利用易得且价廉的甲醇把温室气体CO2转化为环保添加剂,这在资源循环利用和环境保护方面都具有实际意义
B.在温度、容器体积、催化剂用量一定的已经达到平衡的体系中,
加入二氧化碳气体,将提高该反应的TON
C.当催化剂用量小于1.2×10-5mol时,甲醇的平衡转化率随
着催化剂用量的增加而显著提高
D.当催化剂用量大于1.2×10-5 mol时,DRC的产率随着催化剂用量的增加反而急剧下降
(4)200℃时由甲醇和二氧化碳在催化剂作用下直接合成DRC(此时反应物和生成物均为气体.)的平衡常数表达式为
考点:化学平衡的计算,用盖斯定律进行有关反应热的计算,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)分析温度对反应影响分析,随温度升高,TON先增大后减小,说明低温时反应正向进行,180°C达到最大,说明反应达到平衡状态,继续升温TON减小,说明平衡逆向进行,依据平衡移动原理分析正反应是放热反应;
(2)依据图象分析,4~10h内TON为10,依据TON=
,计算转化的甲醇的物质的量,结合反应速率还能计算得到甲醇反应速率,反应速率之比等于化学方程式计量数之比得到DMC的平均反应速率;
(3)在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯(DMC):CO2+2CH3OH→CO(OCH3)2+H2O,依据化学平衡原理和影响因素分析判断平衡移动方向,结合TON=
计算分析判断选项;
(4)依据化学方程式CO2+2CH3OH→CO(OCH3)2+H2O,结合平衡常数概念书写表达式.
(2)依据图象分析,4~10h内TON为10,依据TON=
| 转化的甲醇的物质的量 |
| 催化剂的物质的量 |
(3)在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯(DMC):CO2+2CH3OH→CO(OCH3)2+H2O,依据化学平衡原理和影响因素分析判断平衡移动方向,结合TON=
| 转化的甲醇的物质的量 |
| 催化剂的物质的量 |
(4)依据化学方程式CO2+2CH3OH→CO(OCH3)2+H2O,结合平衡常数概念书写表达式.
解答:
解:(1)随温度升高,TON先增大后减小,说明低温时反应正向进行,180°C达到最大,说明费用达到平衡状态,继续升温TON减小,说明平衡逆向进行,逆反应是吸热反应,依据平衡移动原理分析正反应是放热反应,△H<0,
故答案为:升温平衡向左移动,经过相同的反应时间,温度较低时,反应未达到平衡,温度较高时,反应已达到平衡,随着温度升高,TON减小,即平衡向左移动,说明该反应放热;
(2)图象分析,4~7h内TON为15,依据TON=
,计算转化的甲醇的物质的量=15×0.8×10-5 mol=1.2×10-4mol,反应甲醇的反应速率=
=1×10-3mol/L?h,V(DMC)=
V(CH3OH)=5.0×10-4mol/L?h,10h转化甲醇物质的量=35×0.8×10-5 mol=2.8×10-4mol,甲醇转化率=
×100%=5.6×10-2%
故答案为:5.0×10-4 mol?L-1?h-1;5.6×10-2%;
(3)在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯(DMC):CO2+2CH3OH→CO(OCH3)2+H2O,
A.依据反应化学方程式可知,甲醇和二氧化碳反应生成DMC和水,由甲醇和CO2直接合成DMC,可以利用甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义,故A正确;
B.在反应体系中添加合适的脱水剂,减少生成物浓度,平衡正向进行,将提高该反应的TON,故B正确;
C.当催化剂用量低于1.2×10-5mol时,转化数增大,依据TON=
分析,催化剂改变反应速率缩短反应时间,不改变转化率,故C错误;
D.当催化剂用量高于1.2×10-5mol时,随着催化剂用量的增加,依据TON=
分析,转化数减小,DMC的产率不变,故D错误;
故答案为:CD;
(4)依据化学方程式CO2+2CH3OH→CO(OCH3)2+H2O,结合平衡常数概念书写表达式K=
;若甲醇和DRC的标准燃烧热分别为△H1和△H2,书写燃烧热的热化学方程式①CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H1,②CO(OCH3)2(l)+3O2=3CO2(g)+3H2O(g)△H2,
依据盖斯定律计算①×2-②得到CO2(g)+2CH3OH(l)→CO(OCH3)2(l)+H2O(l),△H3=2△H1-△H2,
则上述反应在25℃时的焓变△H3=2△H1-△H2;
故答案为:
;2△H1-△H2.
故答案为:升温平衡向左移动,经过相同的反应时间,温度较低时,反应未达到平衡,温度较高时,反应已达到平衡,随着温度升高,TON减小,即平衡向左移动,说明该反应放热;
(2)图象分析,4~7h内TON为15,依据TON=
| 转化的甲醇的物质的量 |
| 催化剂的物质的量 |
| ||
| (10-4)h |
| 1 |
| 2 |
| 2.8×10-4mol |
| 0.5mol |
故答案为:5.0×10-4 mol?L-1?h-1;5.6×10-2%;
(3)在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯(DMC):CO2+2CH3OH→CO(OCH3)2+H2O,
A.依据反应化学方程式可知,甲醇和二氧化碳反应生成DMC和水,由甲醇和CO2直接合成DMC,可以利用甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义,故A正确;
B.在反应体系中添加合适的脱水剂,减少生成物浓度,平衡正向进行,将提高该反应的TON,故B正确;
C.当催化剂用量低于1.2×10-5mol时,转化数增大,依据TON=
| 转化的甲醇的物质的量 |
| 催化剂的物质的量 |
D.当催化剂用量高于1.2×10-5mol时,随着催化剂用量的增加,依据TON=
| 转化的甲醇的物质的量 |
| 催化剂的物质的量 |
故答案为:CD;
(4)依据化学方程式CO2+2CH3OH→CO(OCH3)2+H2O,结合平衡常数概念书写表达式K=
| c(H2O)c[CO(OCH3)] |
| c(CO2)c2(CH3OH) |
| 3 |
| 2 |
依据盖斯定律计算①×2-②得到CO2(g)+2CH3OH(l)→CO(OCH3)2(l)+H2O(l),△H3=2△H1-△H2,
则上述反应在25℃时的焓变△H3=2△H1-△H2;
故答案为:
| c(H2O)c[CO(OCH3)] |
| c(CO2)c2(CH3OH) |
点评:本题考查图象分析方法,热化学方程式和燃烧热概念计算,平衡影响因素,反应速率和转化率计算应用,明确习题中的信息及有关计算是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、硫酸铝溶液与过量Ba(OH)2溶液反应 2Al3++3SO42-+3 Ba2++8OH-=3BaSO4↓+2[Al(OH)4]- |
| B、碳酸钠溶液中滴加盐酸至恰好要出现气泡时停止:CO32-+2H+=CO2↑+H2O |
| C、酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+=2Mn2++6H2O+02↑ |
| D、氯气通入亚硫酸钠溶液中:2Cl2+SO32-+H2O=2Cl-+SO2↑+2HClO |
用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A、T℃时,1LpH=6的纯水中,含有的OH-数目为1×10-6NA |
| B、12.0gNaHSO4固体中含有的阳离子数目为0.1NA |
| C、50g98%的浓硫酸中,所含的氧原子数目为2NA |
| D、1molNa2O2与足量CO2充分反应转移的电子数目为NA |
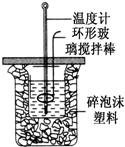 用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热.
用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热.
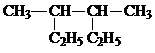 名称:
名称: