题目内容
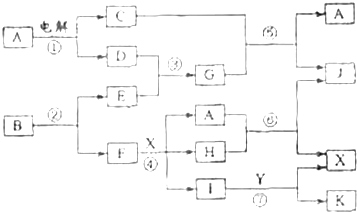
下图是一个实验室制取氯气并以氯气为原料进行特定反应的装置:

(1)A是氯气发生装置,写出该装置发生反应的离子方程式: .
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃F处酒精灯,连接上E装置.此时D装置中的实验现象是: ,装置E的作用是 .
(3)F装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,其产物为CO2和HCl.试写出F中反应的化学方程式: .
(4)在G处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是: .
(5)F处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的A处仍有Cl2产生,此时B中的现象是 .
(6)该装置从环境保护角度来说存在的缺陷是 .

(1)A是氯气发生装置,写出该装置发生反应的离子方程式:
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃F处酒精灯,连接上E装置.此时D装置中的实验现象是:
(3)F装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,其产物为CO2和HCl.试写出F中反应的化学方程式:
(4)在G处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是:
(5)F处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的A处仍有Cl2产生,此时B中的现象是
(6)该装置从环境保护角度来说存在的缺陷是
考点:氯气的实验室制法,氯、溴、碘的性质实验
专题:实验题
分析:(1)二氧化锰与浓盐酸在加热条件下发生反应生成氯化锰、氯气和水;
(2)氯气具有强的氧化性,能够氧化二氧化硫;氯化氢极易溶于水,氯气通过F装置带出水蒸气,进入G中,碳、水蒸气、氯气发生反应生成二氧化碳和氯化氢;
(3)氯气与碳、水蒸气在加热条件下反应生成二氧化碳和氯化氢;
(4)氯化氢溶于水得盐酸,显酸性,氯气与水反应生成次氯酸具有漂白性;
(5)反应完毕后关闭分液漏斗旋塞,移去酒精灯,但由于余热的作用,A处仍有氯气产生,随氯气增多,B中压强增大,液体被压入长颈漏斗中;
(6)氯气有毒,直接排放容易污染空气,应设计尾气处理装置吸收过量的氯气.
(2)氯气具有强的氧化性,能够氧化二氧化硫;氯化氢极易溶于水,氯气通过F装置带出水蒸气,进入G中,碳、水蒸气、氯气发生反应生成二氧化碳和氯化氢;
(3)氯气与碳、水蒸气在加热条件下反应生成二氧化碳和氯化氢;
(4)氯化氢溶于水得盐酸,显酸性,氯气与水反应生成次氯酸具有漂白性;
(5)反应完毕后关闭分液漏斗旋塞,移去酒精灯,但由于余热的作用,A处仍有氯气产生,随氯气增多,B中压强增大,液体被压入长颈漏斗中;
(6)氯气有毒,直接排放容易污染空气,应设计尾气处理装置吸收过量的氯气.
解答:
解:(1)二氧化锰与浓盐酸反应的离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
(2)氯气、二氧化硫、水发生反应:Cl2+SO2+2H2O=2HCl+H2SO4,硫酸与氯化钡发生反应生成硫酸钡白色沉淀
;
装置E中盛有饱和氯化钠溶水,可以除去氯气中的氯化氢,同时可以为F装置中发生的反应提供水蒸气;
故答案为:有白色沉淀生成;除去Cl2中的HCl,提供水蒸气;
(3)氯气与碳、水蒸气在加热条件下反应的化学方程式为:C+2Cl2+2H2O
CO2+4HCl;
故答案为:C+2Cl2+2H2O
CO2+4HCl;
(4)从F处出来的气体中有HCl和Cl2,HCl使石蕊试液变红,Cl2溶于水生成了HClO,又使溶液褪色
,所以在G处,紫色石蕊试液的颜色由紫色变为红色,再变为无色;
故答案为:从F处出来的气体中有HCl和Cl2,HCl使石蕊试液变红,Cl2溶于水生成了HClO,又使溶液褪色;
(5)反应完毕后关闭分液漏斗旋塞,移去酒精灯,但由于余热的作用,A处仍有氯气产生,随氯气增多,B中压强增大,液体被压入长颈漏斗中;
故答案为:长颈漏斗中液面上升,集气瓶中液面下降;
(6)氯气有毒,直接排放容易污染空气,缺少尾气处理装置;
故答案为:Cl2有毒,缺少尾气处理装置.
| ||
故答案为:MnO2+4H++2Cl-
| ||
(2)氯气、二氧化硫、水发生反应:Cl2+SO2+2H2O=2HCl+H2SO4,硫酸与氯化钡发生反应生成硫酸钡白色沉淀
;
装置E中盛有饱和氯化钠溶水,可以除去氯气中的氯化氢,同时可以为F装置中发生的反应提供水蒸气;
故答案为:有白色沉淀生成;除去Cl2中的HCl,提供水蒸气;
(3)氯气与碳、水蒸气在加热条件下反应的化学方程式为:C+2Cl2+2H2O
| ||
故答案为:C+2Cl2+2H2O
| ||
(4)从F处出来的气体中有HCl和Cl2,HCl使石蕊试液变红,Cl2溶于水生成了HClO,又使溶液褪色
,所以在G处,紫色石蕊试液的颜色由紫色变为红色,再变为无色;
故答案为:从F处出来的气体中有HCl和Cl2,HCl使石蕊试液变红,Cl2溶于水生成了HClO,又使溶液褪色;
(5)反应完毕后关闭分液漏斗旋塞,移去酒精灯,但由于余热的作用,A处仍有氯气产生,随氯气增多,B中压强增大,液体被压入长颈漏斗中;
故答案为:长颈漏斗中液面上升,集气瓶中液面下降;
(6)氯气有毒,直接排放容易污染空气,缺少尾气处理装置;
故答案为:Cl2有毒,缺少尾气处理装置.
点评:本题考查了氯气实验室制备,氯气性质验证和除杂方法,明确反应的原理和装置的作用是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组离子,在强酸性溶液中可以大量共存的是( )
| A、K+、Fe2+、SO42-、Br- |
| B、Na+、Al(OH)4-、Cl-、SO42- |
| C、Mg2+、Ca2+、HCO3-、Cl- |
| D、Fe2+、Ca2+、Cl-、NO3- |