题目内容
将等物质的量的A和B混合于2L的密闭容器中,发生如下反应3A+B?xC+2D,经过4min时,测得A的浓度为0.5mol/L,D的浓度为0.5mol/L,C的物质的量是1mol.求:
(1)x的值 .
(2)A在开始时的浓度 .
(1)x的值
(2)A在开始时的浓度
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)根据同一反应中转化的物质的物质的量之比等于化学计量数之比求出x值;
(2)根据D的浓度求出D的物质的量,结合方程式求出A的物质的量.
(2)根据D的浓度求出D的物质的量,结合方程式求出A的物质的量.
解答:
解:(1)根据题意可知生成D的物质的量为0.5mol/L×2L=1mol,C的物质的量为1mol,所以D与C的物质的量之比为1:1,根据同一反应中转化的物质的物质的量之比等于化学计量数之比可知X=2,故答案为:2;
(2)根据方程式3A(g)+B(g)?xC(g)+2D(g)可知,A和D的物质的量之比为3:2,生成1molD消耗A的物质的量为1.5mol,4min时,测得A的浓度为0.5mol/L,所A物质的是为2×0.5mol=1mol,所以A起始的物质的量为1mol+1.5mol=2.5mol,所以A的起始浓度为
=1.25mol/L,故答案为:1.25mol/L.
(2)根据方程式3A(g)+B(g)?xC(g)+2D(g)可知,A和D的物质的量之比为3:2,生成1molD消耗A的物质的量为1.5mol,4min时,测得A的浓度为0.5mol/L,所A物质的是为2×0.5mol=1mol,所以A起始的物质的量为1mol+1.5mol=2.5mol,所以A的起始浓度为
| 2.5mol |
| 2L |
点评:本题考查了化学反应中物质的变化的物质的量与化学计量数的关系,及根据化学方程式计算,难度不大.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
实验中需2mol?L-1的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别是( )
| A、500 mL,106g |
| B、950 mL,201.4g |
| C、任意规格,201.4g |
| D、1000 mL,212g |
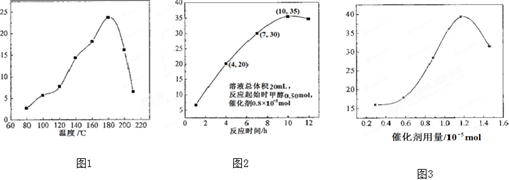
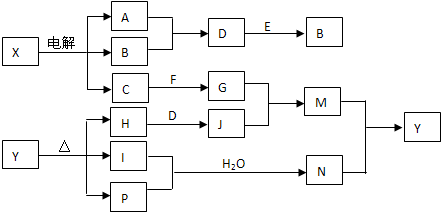
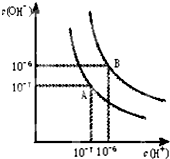 (1)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
(1)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),