题目内容
血红蛋白是脊椎动物血红细胞的一种含铁的复合变构蛋白,如图甲所示为血红蛋白的活性部分-血红素的结构请依据所给信息,回答下列问题:
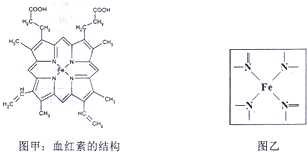
(1)血红素中含有C、H、O、N、Fe五种元素,其中N元素铀14N与15N两种同位素,下列说法正确的是
A、等质量的14N2与15N2所含的中子数之比为14:15
B、14N2与15N2互为同位素
C、14N与15N电子层结构完全相同
D、原子半径:14N小于15N
(2)血红素中N原子的两种杂化方式分别为 ;
(3)C、H、N、O四种元素的电负性由小到大的顺序是 ;
(4)上述非金属元素中最外层有2个未成对电子的元素组成的原子个数比为1:1的分子属于 分子(填“极性”、“非极性”);
(5)写出基态Fe原子的核外电子排布式 ,在如图乙的方框内用“→”标出Fe2+的配位键;
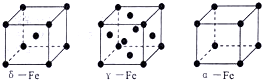
(6)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 ;在δ晶胞中空间利用率为 ,与其具有相同堆积方式的金属还有 (填元素符号).

(1)血红素中含有C、H、O、N、Fe五种元素,其中N元素铀14N与15N两种同位素,下列说法正确的是
A、等质量的14N2与15N2所含的中子数之比为14:15
B、14N2与15N2互为同位素
C、14N与15N电子层结构完全相同
D、原子半径:14N小于15N
(2)血红素中N原子的两种杂化方式分别为
(3)C、H、N、O四种元素的电负性由小到大的顺序是
(4)上述非金属元素中最外层有2个未成对电子的元素组成的原子个数比为1:1的分子属于
(5)写出基态Fe原子的核外电子排布式
(6)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为

考点:原子轨道杂化方式及杂化类型判断,元素周期律的作用,元素电离能、电负性的含义及应用,不同晶体的结构微粒及微粒间作用力的区别
专题:
分析:(1)A.14N2与15N2的中子数分别为14、16;
B.质子数相同,中子数不同的原子为同位素;
C.14N与15N的核外电子数都为7;
D.14N与15N的核外电子排布相同;
(2)根据每个N原子含有的σ 键个数与孤电子对数之和判断其杂化方式;
(3)根据H的电负性最小以及同一周期元素的第一电离能随着原子序数的增大而增大,但第五主族元素的第一电离能大于第六主族元素的;
(4)上述非金属元素中最外层有2个未成对电子的元素组成的原子为C和O,正负电荷重心重合为非极性分子,正负电荷重心不重合为极性分子;
(5)Fe是26元素,核外电子数为26,根据核外电子排布规律书写;配位键由提供孤电子对的原子指向提供空轨道的原子;
(6)利用均摊法计算γ晶体晶胞中所含有的铁原子数;先判断δ、α两种晶胞中铁原子的配位数,再计算其比值;体心立方堆积,空间利用率为68%,为K型,与Na、K、Fe具有相同堆积方式.
B.质子数相同,中子数不同的原子为同位素;
C.14N与15N的核外电子数都为7;
D.14N与15N的核外电子排布相同;
(2)根据每个N原子含有的σ 键个数与孤电子对数之和判断其杂化方式;
(3)根据H的电负性最小以及同一周期元素的第一电离能随着原子序数的增大而增大,但第五主族元素的第一电离能大于第六主族元素的;
(4)上述非金属元素中最外层有2个未成对电子的元素组成的原子为C和O,正负电荷重心重合为非极性分子,正负电荷重心不重合为极性分子;
(5)Fe是26元素,核外电子数为26,根据核外电子排布规律书写;配位键由提供孤电子对的原子指向提供空轨道的原子;
(6)利用均摊法计算γ晶体晶胞中所含有的铁原子数;先判断δ、α两种晶胞中铁原子的配位数,再计算其比值;体心立方堆积,空间利用率为68%,为K型,与Na、K、Fe具有相同堆积方式.
解答:
解:(1)A.14N2与15N2的中子数分别为14、16,所以等质量的14N2与15N2所含的中子数之比为(
×14):(
×16)=15:16,故A错误;
B.14N2与15N2是单质,不属于同位素,故B错误;
C.14N与15N的核外电子数都为7,电子层结构完全相同,故C正确;
D.14N与15N的核外电子排布相同,原子半径相同,故D错误;
故选C.
(2)血红素中N原子有的含有3个σ 键和一个孤电子对,属于sp3杂化;有的含有3个σ 键,属于sp2 杂化方式;
故答案为:sp2和sp3;
(3)同一周期元素的第一电离能随着原子序数的增大而增大,但第五主族元素的第一电离能大于第六主族元素的,则有电负性C<O<N,H的电负性最小,所以H<C<O<N;
故答案为:H<C<O<N;
(4)上述非金属元素中最外层有2个未成对电子的元素组成的原子为C和O,CO是直线形分子,分子结构对称,但正负电荷的中心不重合,属于极性分子;
故答案为:极性;
(5)Fe是26元素,核外电子数为26,态原子的核外电子排布式为1s22s22p63s23p63d64s2;配位键由提供孤电子对的原子指向提供空轨道的原子,Fe2+的配位键为 ;
;
故答案为:1s22s22p63s23p63d64s2; ;
;
(6)该晶胞中顶点上含有的原子数=
×8=1,面心上含有的原子数=
×6=3,所以一个晶胞中含有4个原子;
δ、α两种晶胞中铁原子的配位数分别是8个和6个,所以δ、α两种晶胞中铁原子的配位数之比是4:3;δ晶胞为体心立方堆积,空间利用率为68%,为K型,与Na、K、Fe具有相同堆积方式;
故答案为:4;4:3;68%;Na、K;
| m |
| 28 |
| m |
| 30 |
B.14N2与15N2是单质,不属于同位素,故B错误;
C.14N与15N的核外电子数都为7,电子层结构完全相同,故C正确;
D.14N与15N的核外电子排布相同,原子半径相同,故D错误;
故选C.
(2)血红素中N原子有的含有3个σ 键和一个孤电子对,属于sp3杂化;有的含有3个σ 键,属于sp2 杂化方式;
故答案为:sp2和sp3;
(3)同一周期元素的第一电离能随着原子序数的增大而增大,但第五主族元素的第一电离能大于第六主族元素的,则有电负性C<O<N,H的电负性最小,所以H<C<O<N;
故答案为:H<C<O<N;
(4)上述非金属元素中最外层有2个未成对电子的元素组成的原子为C和O,CO是直线形分子,分子结构对称,但正负电荷的中心不重合,属于极性分子;
故答案为:极性;
(5)Fe是26元素,核外电子数为26,态原子的核外电子排布式为1s22s22p63s23p63d64s2;配位键由提供孤电子对的原子指向提供空轨道的原子,Fe2+的配位键为
 ;
;故答案为:1s22s22p63s23p63d64s2;
 ;
;(6)该晶胞中顶点上含有的原子数=
| 1 |
| 8 |
| 1 |
| 2 |
δ、α两种晶胞中铁原子的配位数分别是8个和6个,所以δ、α两种晶胞中铁原子的配位数之比是4:3;δ晶胞为体心立方堆积,空间利用率为68%,为K型,与Na、K、Fe具有相同堆积方式;
故答案为:4;4:3;68%;Na、K;
点评:本题考查了物质结构中的有关知识,涉及电负性、电负性、配位键、杂化方式以及晶胞的计算等问题,题目难度较大,易错点为(6).注意利用均摊法计算晶胞.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
在解释下列物质性质的变化规律与物质结构间的因果关系时,与化学键的强弱无关的变化规律是( )
| A、HF、HCl、HBr、HI的热稳定依次减弱 |
| B、金刚石的硬度大于硅,其熔、沸点也高于硅 |
| C、NaF、NaCl、NaBr、NaI的熔点依次减小 |
| D、F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
下列有关实验说法不正确的是( )
| A、在用简易量热计测定反应热时,可使用碎泡沫起隔热保温作用、环形玻璃搅拌棒进行搅拌使其充分反应、读取反应中温度计的最高温度、取2-3 次的实验平均值,以达到良好的实验效果 |
| B、纸上层析属于色谱分析法,其原理仅和“毛细现象”相关 |
| C、向1mL0.5mol?L-1AlCl3溶液中滴加2mL饱和NaF溶液,再滴加1mL 3.0mol?L-1 NH3?H2O溶液,无沉淀生成,说明Al3+更易与F-结合成AlF63-- |
| D、为了使过饱和溶液中析出晶体,可用玻璃棒摩擦与溶液接触处的试管壁 |
某种兴奋剂是奥运会上最早使用并最早被禁用,其结构简式如下:下列有关叙述正确的是( )


| A、该物质属于芳香族化合物,分子式为C13H12O4Cl2 |
| B、该物质分子内处于同一平面的碳原子不超过7个 |
| C、1 mol该物质最多可与5 mol H2发生加成反应 |
| D、1 mol该物质最多可与含3 mol NaOH的水溶液发生反应 |
用水稀释0.1mol/L氨水时,溶液中随水量的增加而减小的是( )
A、
| ||
B、
| ||
| C、c(H+) | ||
| D、n(OH-) |
 氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.
氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.