题目内容
将2.0molPCl3和2.0molCl2充入体积不变的1L密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)?PCl5(g) 达到平衡时,PCl5为1.0mol;如果此时将PCl3和Cl2全部移走,在相同温度下再达平衡时PCl5的物质的量是( )
| A、0.38mol |
| B、0.50mol |
| C、0.62mol |
| D、无法确定 |
考点:化学平衡的计算
专题:
分析:达平衡后移走1.0mol PC13和1.0mol C12,重新到达的平衡,可以等效为开始加入1.0mol PC13和1.0mol C12到达的平衡,与原平衡相比压强减小,平衡向逆反应移动,反应物的转化率减小,依据平衡常数计算.
解答:
解:达平衡后移走1.0mol PC13和1.0mol C12,重新到达的平衡,可以等效为开始加入1.0mol PC13和1.0mol C12到达的平衡,与原平衡相比压强减小,平衡向逆反应移动,反应物的转化率减小,结合化学平衡三段式列式计算
PCl3(g)+Cl2(g)?PCl5(g)
起始量(mol) 2 2 0
变化量(mol) 1 1 1
平衡量(mol) 1 1 1
平衡常数K=
=1
如果此时将PCl3和Cl2全部移走,相当于开始加入1.0mol PC13和1.0mol C12到达的平衡,设氯气反应物质的量为x
PCl3(g)+Cl2(g)?PCl5(g)
起始量(mol) 1.0 1.0 0
变化量(mol) x x x
平衡量(mol) 1.0-x 1.0-x x
平衡常数K=
=1
x=0.38mol;
故选A.
PCl3(g)+Cl2(g)?PCl5(g)
起始量(mol) 2 2 0
变化量(mol) 1 1 1
平衡量(mol) 1 1 1
平衡常数K=
| 1 |
| 1×1 |
如果此时将PCl3和Cl2全部移走,相当于开始加入1.0mol PC13和1.0mol C12到达的平衡,设氯气反应物质的量为x
PCl3(g)+Cl2(g)?PCl5(g)
起始量(mol) 1.0 1.0 0
变化量(mol) x x x
平衡量(mol) 1.0-x 1.0-x x
平衡常数K=
| x |
| (1-x)2 |
x=0.38mol;
故选A.
点评:本题考查化学平衡的有关影响因素分析,化学平衡的建立等,难度中等,关键是设计等效平衡建立的途径,化学平衡移动原理的理解应用时关键.

练习册系列答案
相关题目
下列有关实验说法不正确的是( )
| A、在用简易量热计测定反应热时,可使用碎泡沫起隔热保温作用、环形玻璃搅拌棒进行搅拌使其充分反应、读取反应中温度计的最高温度、取2-3 次的实验平均值,以达到良好的实验效果 |
| B、纸上层析属于色谱分析法,其原理仅和“毛细现象”相关 |
| C、向1mL0.5mol?L-1AlCl3溶液中滴加2mL饱和NaF溶液,再滴加1mL 3.0mol?L-1 NH3?H2O溶液,无沉淀生成,说明Al3+更易与F-结合成AlF63-- |
| D、为了使过饱和溶液中析出晶体,可用玻璃棒摩擦与溶液接触处的试管壁 |
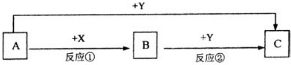 A、B、C三种物质的转化关系如图所示(部分产物已略去)
A、B、C三种物质的转化关系如图所示(部分产物已略去)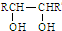
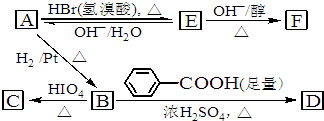
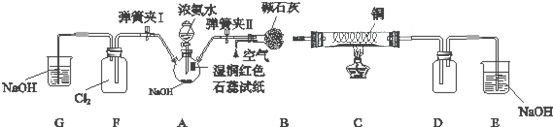
 氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.
氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.