题目内容
1. 50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:(1)如果将环形玻璃搅拌棒改为环形金属(如铜)棒,对求得中和热数值的影响是偏低(填“偏高”、“偏低”或“无影响”).
(2)如果改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量增加(填“增加”、“减少”或“不变”),所求中和热数值不变(填“增加”、“减少”或“不变”);
(3)不能用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是H2SO4与Ba(OH)2反应生成的BaSO4沉淀时也有能量变化(或放热);
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录如表原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2•t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.7 | 6.7 |
| 2 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
| 3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度.
分析 (1)环形铜棒是热的良导体,会使热量损失;
(2)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(3)氢氧化钡与硫酸反应生成了硫酸钡沉淀,生成沉淀的过程中会有热量变化;
(4)先求出三次反应的温度差,根据公式Q=cm△T来求出生成0.05mol的水放出热量,从而求出中和热;
(5)a.装置保温、隔热效果差,测得的热量偏小;
b.量取NaOH溶液的体积时仰视读数,会导致所量的NaOH溶液体积偏大,放出的热量偏高;
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失较多;
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度,HCl溶液的起始温度偏高.
解答 解:(1)金属铜的导热效果好于环形玻璃搅拌棒,会使热量损失,中和热数值偏低;
故答案为:偏低;
(2)反应放出的热量和所用酸以及碱的量的多少有关,如果改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以与上述实验相比,测得中和热数值相等;
故答案为:增加;不变;
(3)硫酸与Ba(OH)2溶液反应除了生成水外,还生成了BaSO4沉淀,该反应中的生成热会影响反应的反应热,所以不能用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液;
故答案为:H2SO4与Ba(OH)2反应生成的BaSO4沉淀时也有能量变化(或放热);
(4)3次实验的前后温度差分别为:6.6℃,6.7℃,6.8℃,均有效,三次的平均值为6.7℃,50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液的质量和为m=100mL×1g/mL=100g,c=4.184J/(g•℃),反应生成0.05mol水,代入公式Q=cm△T得生成0.05mol的水放出热量Q=4.184J/(g•℃)×100g×6.7℃=2.80328kJ,即生成0.05mol的水放出热量2.80328kJ,所以生成1mol的水放出热量为$\frac{2.80328kJ}{0.05mol}$=28.006KJ×20=56.06kJ,即该实验测得的中和热△H=-56.06kJ/mol;
故答案为:-56.06kJ/mol;
(5)a、装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的NaOH溶液体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,故c正确;
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度,HCl溶液的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故选acd.
点评 本题考查了中和热的测定方法,题目难度中等,明确测定中和热的原理是解题的关键,注意掌握中和热的概念及计算方法,试题培养了学生的分析能力及化学实验能力.

| A. | 7.1 g 37Cl2含有的中子数为4NA | |
| B. | NA个Al(OH)3胶体粒子的质量为78 g | |
| C. | 7.8 g Na2O2晶体中阴阳离子总数为0.3NA | |
| D. | 标准状况下,2.24 L己烷含有的共价键数为1.9NA |
 纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$ Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(2)己知:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-akJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(s)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法I发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=2c-a-bkJ•mol-1.
(3)方法II采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O.
(4)方法III为加热条件下用液态拼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0
水蒸气的浓度随时间t变化如表所示.
| 序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
A.实验温度:T1<T2
B.实验①前20min的平均反应速率v(O2)=7×10-5mol/(L•min)
C.实验②比实验①所用的催化剂效率高
(6)25℃时,向50mL0.018mol/L的AgNO3溶液中加入50mL0.02mol/L盐酸,生成沉淀.若已知Ksp(AgCl)=1.8×10-10,则此时溶液中的c(Ag+)=1.8×10-7mol/L.(体积变化忽略不计)若再向沉淀生成后的溶液中加入100mL0.001mol/L盐酸,是否继续产生沉淀否(填“是”或“否”).
| A. | 175 | B. | 47 | C. | 118 | D. | 57 |
| A. | 简单离子半径:Z>W>Y | |
| B. | 气态氢化物的稳定性:Z<W | |
| C. | Z的氢化物能与其最高价氧化物对应的水化物反应 | |
| D. | 在X2和W2构成的燃料电池中,W2作负极 |
 的同分异构体.且分子中只有两仲不同化学环境的氢.写出该化合物的结构简式
的同分异构体.且分子中只有两仲不同化学环境的氢.写出该化合物的结构简式 或
或 (任写一种)
(任写一种)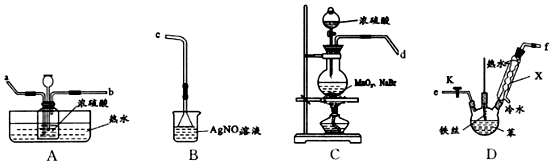
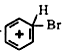
 ;仪器X的名称为球形冷凝管.
;仪器X的名称为球形冷凝管. ?
?
 ;
;