题目内容
13.美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、质量数为293的超重元素,该元素原子核内的中子数和核外电子数之差为( )| A. | 175 | B. | 47 | C. | 118 | D. | 57 |
分析 原子的质量数=质子数+中子数,据此计算出该原子的中子数,然后计算出该元素原子核内的中子数和核外电子数之差.
解答 解:质子数为118、质量数为293的超重元素的中子数=质量数-质子数=293-118=175,
该原子的核外电子数=质子数=118,则该元素原子核内的中子数和核外电子数之差=175-118=57,
故选D.
点评 本题考查了原子构成,题目难度不大,明确质量数与质子数、中子数之间的关系即可解答,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1. 50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
(1)如果将环形玻璃搅拌棒改为环形金属(如铜)棒,对求得中和热数值的影响是偏低(填“偏高”、“偏低”或“无影响”).
(2)如果改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量增加(填“增加”、“减少”或“不变”),所求中和热数值不变(填“增加”、“减少”或“不变”);
(3)不能用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是H2SO4与Ba(OH)2反应生成的BaSO4沉淀时也有能量变化(或放热);
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录如表原始数据.
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容C=4.184×10-3 kJ/(g•℃),则该反应的中和热为△H=-56.06kJ/mol(保留小数点后一位).
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度.
 50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:(1)如果将环形玻璃搅拌棒改为环形金属(如铜)棒,对求得中和热数值的影响是偏低(填“偏高”、“偏低”或“无影响”).
(2)如果改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量增加(填“增加”、“减少”或“不变”),所求中和热数值不变(填“增加”、“减少”或“不变”);
(3)不能用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是H2SO4与Ba(OH)2反应生成的BaSO4沉淀时也有能量变化(或放热);
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录如表原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2•t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.7 | 6.7 |
| 2 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
| 3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度.
18.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素.下列说法正确的是( )
| A. | 元素C、D、E的最高价氧化物对应的水化物之间两两都可以发生反应 | |
| B. | 1mol由元素A、B组成且含有18 mol e-的化合物只有一种 | |
| C. | 含D元素的盐溶液只能显酸性,不可能显碱性 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
5.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向FeSO4溶液中先滴入KSCN 溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| B | 常温下将铜片放入浓硫酸中 | 生成刺激性气味的气体 | 反应生成了SO2 |
| C | 室温下,向浓度均为0.1mol•L-1的BaC12和CaCl2混合溶液中滴加Na2SO4溶液 | 出现白色沉淀 | Ksp(BaSO4)<Ksp(CaSO4) |
| D | 向Ba(NO3)2溶液中通入SO2气体 | 有白色沉淀生成 | 沉淀是BaSO4 |
| A. | A | B. | B | C. | C | D. | D |
2.分子式为C5H10O2且可NaHCO3溶液反应生成CO2的有机化合物有(不含立体异构)( )
| A. | 4种 | B. | 6种 | C. | 7种 | D. | 9种 |
3.NaClO溶液可用于漂白,其漂白速率随pH降低逐渐增大,当pH<4时,漂白速率增大更快,此时起漂白作用的主要是Cl2.下列说法不正确的是( )
| A. | 保存NaClO溶液时加入少量NaOH可以抑制水解 | |
| B. | pH<4时,起漂白作用的Cl2是HClO分解产生的 | |
| C. | 随pH降低,溶液中HClO和Cl2增多,所以漂白速率加快 | |
| D. | 用NaClO溶液漂白色素时,不同条件下由不同成分起到漂白作用 |
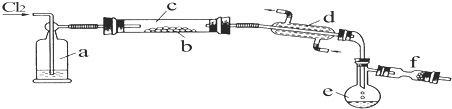
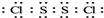 .
. 某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对原子质量.
某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对原子质量.