题目内容
6.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 7.1 g 37Cl2含有的中子数为4NA | |
| B. | NA个Al(OH)3胶体粒子的质量为78 g | |
| C. | 7.8 g Na2O2晶体中阴阳离子总数为0.3NA | |
| D. | 标准状况下,2.24 L己烷含有的共价键数为1.9NA |
分析 A.1个37Cl含有20个中子;
B.1个个Al(OH)3胶体粒子,含有多个Al(OH)3;
C.过氧化钠阳离子为钠离子,阴离子为过氧根离子;
D.气体摩尔体积使用对象为气体.
解答 解:A.7.1 g 37Cl2物质的量为$\frac{7.1g}{74g/mol}$<0.01mol,含有的中子数小于4NA,故A错误;
B.NA个Al(OH)3胶体粒子的质量大于78 g,故B错误;
C.7.8 g Na2O2晶体物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,含有0.2mol钠离子和0.1mol过氧根离子,共含有阴阳离子总数为0.3NA,故C正确;
D.气体摩尔体积使用对象为气体,标况下己烷为液体,不能使用气体摩尔体积,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的有关计算及应用,掌握以物质的量的为核心计算公式和物质结构是解题关键,难度不大,注意气体摩尔体积使用对象为气体.

练习册系列答案
相关题目
16.化学在日常生活中有着广泛的应用,下列对应项不存在因果关系的是( )
| 物质性质 | 实际应用 | |
| A | 硅胶吸水能力强 | 食品、药品干燥剂 |
| B | 油脂在碱性条件下水解 | 制肥皂 |
| C | SiO2是酸性氧化物 | 光导纤维 |
| D | Na2O2与CO2、H2O反应 | 潜水艇中作为氧气来源 |
| A. | A | B. | B | C. | C | D. | D |
17.短周期主族元素 X、Y、Z、W的原子序数依次增大,X原子最外层电子比次外层多4个,Y、Z为相邻金属元素,Z的简单离子半径在同周期元素中最小,W与X同族. 下列说法不正确的是( )
| A. | 原子半径:Y>Z>W>X | |
| B. | 气态氢化物的热稳定性:X>W | |
| C. | 工业上常用电解对应氯化物的方法制备单质 Z | |
| D. | Y 的最高价氧化物对应的水化物可溶于氯化铵溶液 |
14.含氯消毒液(主要成分NaClO)与含氯洁厕灵(主要成分HCl)混用可能会造成中毒,其原因是:NaClO+2HCl=Cl2↑+NaCl+H2O,下列说法中正确的是( )
| A. | NaCl的电子式为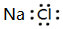 | |
| B. | NaClO只含有离子键 | |
| C. | 当释放2.24L Cl2时,一定有6.02×1022个氯分子扩散到室内 | |
| D. | 使用消毒液时滴加食醋可加快作用发挥,其原因用离子方程式表示为:ClO-+CH3COOH=HClO+CH3COO- |
1.利用石墨电极电解1mol/L氯化钠溶液,并收集阳极气体检验其成分.已知:O2能使酸性的淀粉KI溶液变蓝,不能使中性的淀粉KI溶液变蓝.
实验:
①将气体通入中性的淀粉KI溶液中,溶液变蓝.
②用足量NaOH溶液充分洗气,气体体积减少,将剩余气体通入中性的淀粉KI溶液中,溶液颜色不变,再向溶液中滴加2滴H2SO4溶液,溶液变蓝.
③向酸性的淀粉KI溶液中通入空气,溶液颜色不变.
下列对实验现象的解释或推测不合理的是( )
实验:
①将气体通入中性的淀粉KI溶液中,溶液变蓝.
②用足量NaOH溶液充分洗气,气体体积减少,将剩余气体通入中性的淀粉KI溶液中,溶液颜色不变,再向溶液中滴加2滴H2SO4溶液,溶液变蓝.
③向酸性的淀粉KI溶液中通入空气,溶液颜色不变.
下列对实验现象的解释或推测不合理的是( )
| A. | NaOH溶液洗气时发生反应的离子方程式为:2OH-+Cl2═Cl-+ClO-+H2O | |
| B. | 根据实验可以得出中性条件下,氧化性Cl2>O2 | |
| C. | 根据实验可以得出反应物的浓度和溶液的pH会影响物质的氧化性 | |
| D. | 根据实验现象可以判断电解时阳极的电极反应式为:2Cl--2e-═Cl2↑ |
11.下列叙述正确的是( )
| A. | 做“钠与水的反应”实验时.切取绿豆大小的金属钠,用滤纸吸干表面煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象 | |
| B. | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置;下层液体显紫红色;则氧化性:Fe3+>I2 | |
| C. | 测定等浓度的Na2CO3和Na2SO3 溶液的pH;前者pH 比后者的大;则非金属性:S>C | |
| D. | 溴乙烷与 NaOH 溶液共热后,加入AgNO3溶液;未出现淡黄色沉淀;说明溴乙烷没有水解 |
20.两份铝屑,第一份与足量盐酸反应,第二份与足量氢氧化钠溶液反应,产生的氢气的体积比为1:1,则消耗的盐酸和氢氧化钠的物质的量比为( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:1 |
1. 50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
(1)如果将环形玻璃搅拌棒改为环形金属(如铜)棒,对求得中和热数值的影响是偏低(填“偏高”、“偏低”或“无影响”).
(2)如果改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量增加(填“增加”、“减少”或“不变”),所求中和热数值不变(填“增加”、“减少”或“不变”);
(3)不能用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是H2SO4与Ba(OH)2反应生成的BaSO4沉淀时也有能量变化(或放热);
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录如表原始数据.
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容C=4.184×10-3 kJ/(g•℃),则该反应的中和热为△H=-56.06kJ/mol(保留小数点后一位).
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度.
 50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:(1)如果将环形玻璃搅拌棒改为环形金属(如铜)棒,对求得中和热数值的影响是偏低(填“偏高”、“偏低”或“无影响”).
(2)如果改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量增加(填“增加”、“减少”或“不变”),所求中和热数值不变(填“增加”、“减少”或“不变”);
(3)不能用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是H2SO4与Ba(OH)2反应生成的BaSO4沉淀时也有能量变化(或放热);
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录如表原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2•t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.7 | 6.7 |
| 2 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
| 3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度.
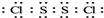 .
.