题目内容
11.现有X、Y、Z、W四种短周期元素,X、Y位于同主族,Z、W位于同主族且Z的核电荷数是W的2倍,Y、Z位于同周期,X与Z、W都不在同一周期.下列说法不正确的是( )| A. | 简单离子半径:Z>W>Y | |
| B. | 气态氢化物的稳定性:Z<W | |
| C. | Z的氢化物能与其最高价氧化物对应的水化物反应 | |
| D. | 在X2和W2构成的燃料电池中,W2作负极 |
分析 X、Y、Z、W四种短周期元素,Z、W位于同主族且Z的核电荷数是W的2倍,则Z为S,W为O;X、Y位于同主族,Y、Z位于同周期,X与Z、W都不在同一周期,则X为H,Y为Na,以此来解答.
解答 解:由上述分析可知,X为H,Y为Na,Z为S,W为O,
A.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则简单离子半径:Z>W>Y,故A正确;
B.非金属性Z<W,则气态氢化物的稳定性:Z<W,故B正确;
C.Z的氢化物为硫化氢,能与其最高价氧化物对应的水化物浓硫酸,发生氧化还原反应,故C正确;
D.X2和W2构成的燃料电池中,W2作正极得到电子,故D错误;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子序数、元素的位置推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
1. 50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
(1)如果将环形玻璃搅拌棒改为环形金属(如铜)棒,对求得中和热数值的影响是偏低(填“偏高”、“偏低”或“无影响”).
(2)如果改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量增加(填“增加”、“减少”或“不变”),所求中和热数值不变(填“增加”、“减少”或“不变”);
(3)不能用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是H2SO4与Ba(OH)2反应生成的BaSO4沉淀时也有能量变化(或放热);
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录如表原始数据.
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容C=4.184×10-3 kJ/(g•℃),则该反应的中和热为△H=-56.06kJ/mol(保留小数点后一位).
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度.
 50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:(1)如果将环形玻璃搅拌棒改为环形金属(如铜)棒,对求得中和热数值的影响是偏低(填“偏高”、“偏低”或“无影响”).
(2)如果改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量增加(填“增加”、“减少”或“不变”),所求中和热数值不变(填“增加”、“减少”或“不变”);
(3)不能用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是H2SO4与Ba(OH)2反应生成的BaSO4沉淀时也有能量变化(或放热);
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录如表原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2•t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.7 | 6.7 |
| 2 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
| 3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度.
2.分子式为C5H10O2且可NaHCO3溶液反应生成CO2的有机化合物有(不含立体异构)( )
| A. | 4种 | B. | 6种 | C. | 7种 | D. | 9种 |
19.向含有a mol NaOH和a mol Ba(OH)2的混合液中通入b mol CO2气体,充分反应后(忽略水解对离子浓度变化的影响),下列说法不正确的是( )
| A. | 当a=b时,发生的离子总反应为:2OH-+CO2+Ba2+═BaCO3↓+H2O | |
| B. | 当3a=2b时,发生的离子总反应为:6OH-+3CO2+2Ba2+═2BaCO3↓+3H2O+CO32- | |
| C. | 当$\frac{3}{2}$a<b<3a时,溶液中含有n(CO32-):n(HCO3-)=(3a-b):(2b-3a) | |
| D. | 当3a=b时,溶液中Na+、Ba2+与HCO3-的物质的量之比为1:1:3 |
6.已知还原性SO32->I-,某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该无色溶液中加入少量溴水,溶液仍无色.则下列关于该溶液组成的判断正确的是( )
| A. | 肯定不含I- | B. | 可能不含Cu2+ | C. | 可能含有SO32- | D. | 以上结论都不对 |
16.已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得.
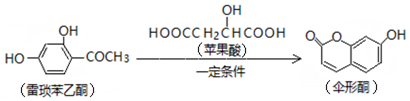
下列说法中正确的是( )

下列说法中正确的是( )
| A. | 一分子雷琐苯乙酮含有3个碳碳双键 | |
| B. | 苹果酸的一种缩聚产物是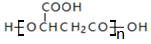 | |
| C. | 1mol伞形酮与足量NaOH溶液反应,最多可消耗2mol NaOH | |
| D. | 雷琐苯乙酮、苹果酸、伞形酮都能跟FeCl3溶液发生显色反应 |
3.NaClO溶液可用于漂白,其漂白速率随pH降低逐渐增大,当pH<4时,漂白速率增大更快,此时起漂白作用的主要是Cl2.下列说法不正确的是( )
| A. | 保存NaClO溶液时加入少量NaOH可以抑制水解 | |
| B. | pH<4时,起漂白作用的Cl2是HClO分解产生的 | |
| C. | 随pH降低,溶液中HClO和Cl2增多,所以漂白速率加快 | |
| D. | 用NaClO溶液漂白色素时,不同条件下由不同成分起到漂白作用 |
20.下列说法正确的是( )
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 | |
| C. | 50℃时,NH4Cl和HCl的混合液中:c(NH4+)+c(H+)=c(OH-)+c(Cl-) | |
| D. | 0.1molAgCl和0.1molAgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) |
 .
.