题目内容
14.某海域海水一些化学成分如表所示,已知:25℃时,Ksp(CaCO3)=2.8×10-9、Ksp(MgCO3)=6.8×10-6,
Ksp[Mg(OH)2]=1.8×10-11.
| 海水成分 | Na+ | Ca2+ | Mg2+ | HCO3- | Zn2+ |
| 含量/mol•L-1 | 0.4 | 0.002 | 0.045 | 0.002 | 10-7 |
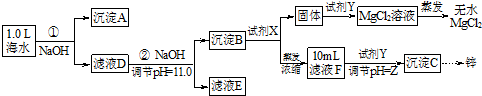
[假设①②过程溶液体积不变,忽略分离过程的损失]
(1)25℃时测得海水的pH> 7.0(填“>”、“<”、“﹦”),其原因是(写离子方程式)HCO3-+H2O?H2CO3+OH-.
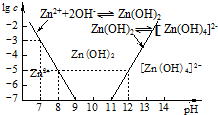
(2)如图为溶液pH与对应的Zn2+、[Zn(OH)4]2-物质的量浓度的对数坐标图.请结合图中数据回答:试剂Y的化学式为HCl;由滤液F到沉淀C过程(一般认为离子浓度低于10-5mol/L就是沉淀完全),则调节的pH范围为8<pH<12.
(3)同学们发现,把MgCl2溶液蒸干、灼烧所得的白色固体难溶于水,你认为其主要成分是MgO.原因是(用化学方程式表示)MgCl2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2HCl↑、Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O.
(4)由图中c(Zn2+)计算Zn(OH)2的溶度积Ksp=10-17.
分析 海水中的成分为Na+、Ca2+、Mg2+、HCO3-、Zn2+,加氢氧化钠,与HCO3-反应生成CO32-再和Ca2+结合生成沉淀A碳酸钙,过滤,滤液中含有Na+、Mg2+、Zn2+,再加氢氧化钠溶液调节pH=11,Mg2+和Zn2+转化为沉淀B,则沉淀B为Mg(OH)2和Zn(OH)2,在沉淀B中加足量氢氧化钠,Zn(OH)2转化为[Zn(OH)4]2-,过滤,滤液为含有
[Zn(OH)4]2-的溶液,滤渣为Mg(OH)2,在氢氧化镁中加盐酸溶解得到氯化镁溶液,蒸发得到MgCl2,在含有[Zn(OH)4]2-的溶液中加盐酸,调节pH,使其转化为氢氧化锌沉淀;
(1)根据HCO3-能发生水解反应分析;
(2)根据流程分析判断Y;由图2可知当pH<12时,[Zn(OH)4]2-的浓度小于10-5mol/L,当pH<8时会转化为锌离子;
(3)在溶液中加热促进MgCl2水解生成Mg(OH)2,灼烧Mg(OH)2分解生成MgO;
(4)由图2可知pH=7时,c(Zn2+)=10-3mol/L,根据Ksp[Zn(OH)2]=c(Zn2+)×c2(OH-)计算.
解答 解:海水中的成分为Na+、Ca2+、Mg2+、HCO3-、Zn2+,加氢氧化钠,与HCO3-反应生成CO32-再和Ca2+结合生成沉淀A碳酸钙,过滤,滤液中含有Na+、Mg2+、Zn2+,再加氢氧化钠溶液调节pH=11,Mg2+和Zn2+转化为沉淀B,则沉淀B为Mg(OH)2和Zn(OH)2,在沉淀B中加足量氢氧化钠,Zn(OH)2转化为[Zn(OH)4]2-,过滤,滤液为含有[Zn(OH)4]2-的溶液,滤渣为Mg(OH)2,在氢氧化镁中加盐酸溶解得到氯化镁溶液,蒸发得到MgCl2,在含有[Zn(OH)4]2-的溶液中加盐酸,调节pH,使其转化为氢氧化锌沉淀;
(1)海水中含有HCO3-,HCO3-能发生水解反应,离子方程式为:HCO3-+H2O?H2CO3+OH-,溶液呈碱性,溶液的pH大于7,
故答案为:>;HCO3-+H2O?H2CO3+OH-;
(2)根据流程分析可知X为氢氧化钠溶液,Y为HCl;由图2可知当pH<12时,[Zn(OH)4]2-的浓度小于10-5mol/L,当pH<8时会转化为锌离子,则调节的pH的范围为8<pH<12,
故答案为:HCl;8<pH<12;
(3)在溶液中加热促进MgCl2水解生成Mg(OH)2,灼烧Mg(OH)2分解生成MgO,发生的反应分别为:MgCl2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2HCl↑、Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O;所以把MgCl2溶液蒸发、灼烧所得的白色固体为MgO,
故答案为:MgO;MgCl2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2HCl↑;Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O;
(4)由图2可知pH=7时,c(Zn2+)=10-3mol/L,则c(OH-)=10-7mol/L,Ksp[Zn(OH)2]=c(Zn2+)×c2(OH-)=10-3×(10-7)2=10-17,
故答案为:10-17.
点评 本题考查性质方案的设计,题目难度中等,涉及物质的分离提纯、工艺流程的分析、盐的水解原理的应用、溶度积常数的计算等知识,正确分析制备流程为解答关键,试题培养了学生的分析能力及化学实验能力.

(1)铁在自然界中以化合态存在,其氧化物呈黑色的是FeO、Fe3O4,呈红棕色的是Fe2O3(填写化学式).
(2)铁在纯氧气中燃烧的化学方程式为3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
红热的铁片投入水中,表面生成一层黑色晶体,反应的化学方程式为3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(3)铁合金有下列数据:
| 钢 | |||
| 碳素钢(Fe、C、Mn、Si) | 合金钢 | ||
| 低碳钢 | 中碳钢 | 高碳钢 | 碳素钢+Cr、Mn、W、Ni、Co等 |
| 含碳量<0.3% | 含碳量0.3%~0.6% | 含碳量>0.6% | |
| 韧性好,强度低 | 韧性好、强度好 | 硬而脆 | 具有特殊性能 |
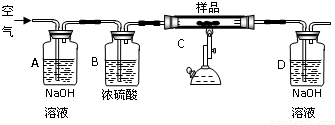
①A、B的作用是除去空气中的二氧化碳和水蒸气,
②充分加热完全反应后,D装置质量增加0.33g,该样品属于中碳钢.
③没有A、B装置,实验结果偏高(填“偏高”“偏低”“不影响”)
| 选项 | 操作 | 现象 | 结论 |
| A | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3?H2O能大量共存 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 将一小块Na放入无水乙醇中 | 产生气泡 | Na能置换出醇羟基中的氢 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1 mol任何物质都含有6.02×1023个原子 | |
| B. | 标准状况下,22.4L NH3的物质的量为1mol | |
| C. | 硫酸的摩尔质量是98 g | |
| D. | 常温常压下,1 mol氧气的体积为22.4 L |
| A. | 洗涤沉淀时,应用玻璃棒轻轻搅拌,使得沉淀表面上的杂质溶于水中 | |
| B. | 将两块未擦去氧化膜的铝片分别投入1mol?L-1CuSO4溶液、1mol?L-1CuCl2溶液中,一段时间后,铝片表面都观察不到明显的反应现象 | |
| C. | 由锌、铜、稀硫酸构成的原电池溶液中加入适量的H2O2能提高电池的放电效率 | |
| D. | 在淀粉溶液中加入适量稀硫酸微热,再加少量新制氢氧化铜浊液加热,若无砖红色沉淀产生,则淀粉未发生水解 |
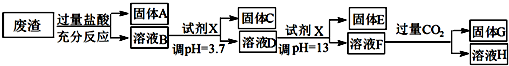
已知常温条件下:
①阳离子以氢氧化物形式完全沉淀(阳离子浓度低于10?5mol•L-1)时溶液的pH:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| pH | 3.4 | 5.2 | 11 |
请回答:
(1)写出A与氢氟酸反应的化学方程式:SiO2+4HF=SiF4↑+2H2O.
(2)上述流程中两次使用试剂X,推测试剂X是氢氧化钠(填“氨水”或“氢氧化钠”)其理由是经过计算饱和氨水的pH=11,使用氨水不能将溶液调至pH=13,所以选择氢氧化钠调节溶液酸碱性.
(3)写出F→H的反应离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是镁离子沉淀不完全或氢氧化铝溶解不完全.
(5)固体C跟HI反应的离子方程式为:2Fe(OH)3+2I-+6H+=2Fe2++I2+6H2O.
(6)试计算Mg(OH)2的Ksp=10-11.
| A. | C4H10 O (醇类) | B. | C3H6Cl(不饱和卤代烃) | ||
| C. | C4H8O2(酯类) | D. | C9H12(芳香烃) |
| A. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| B. | 氯气通入澄清石灰水中:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO${\;}_{3}^{2-}$+2HClO | |
| D. | 等体积、等物质的量浓度AlCl3与NaOH溶液混合:Al3++4OH-═AlO2-+H2O |
| A. | 分子中含有碳碳三键的不饱和链烃 | |
| B. | 易发生加成反应 | |
| C. | 既能使溴水褪色,也能使酸性高锰酸钾溶液褪色 | |
| D. | 分子里所有的碳原子都处于同一直线上 |