题目内容
2.下列叙述正确的是( )| A. | 1 mol任何物质都含有6.02×1023个原子 | |
| B. | 标准状况下,22.4L NH3的物质的量为1mol | |
| C. | 硫酸的摩尔质量是98 g | |
| D. | 常温常压下,1 mol氧气的体积为22.4 L |
分析 A.有些物质是多原子分子;
B.标况下,气体摩尔体积是22.4L/mol;
C.摩尔质量是g/mol;
D.常温常压下,气体摩尔体积大于22.4L/mol.
解答 解:A.有些物质是多原子分子,如臭氧是三原子分子,则1 mol任何物质不一定有6.02×1023个原子,故A错误;
B.标况下,气体摩尔体积是22.4L/mol,标准状况下,22.4L NH3的物质的量为1mol,故B正确;
C.摩尔质量是g/mol,硫酸的摩尔质量是98 g/mol,故C错误;
D.常温常压下,气体摩尔体积大于22.4L/mol,常温常压下1 mol氧气的体积大于22.4 L,故D错误;
故选B.
点评 本题考查物质的量的有关计算,为高频考点,明确气体摩尔体积适用范围及其适用条件是解本题关键,易错选项是BD.

练习册系列答案
相关题目
12.下列电离或水解方程式书写正确的是( )
| A. | NaHCO3═CO32-+H++Na+ | B. | S2-+H2O?H2S+2 OH- | ||
| C. | H3PO4?3H++PO43- | D. | NH3•H2O?NH4++OH- |
13.下列离子方程式书写正确的是( )
| A. | 向氯化钙溶液中通入CO2:Ca2++H2O+CO2═CaCO3↓+2H+ | |
| B. | 稀硫酸与氧化铜反应:O2-+2H+═H2O | |
| C. | 碳酸钡与盐酸反应:BaCO3+2H+═Ba2++CO2↑+H2O | |
| D. | 将氯气通入碱溶液中:Cl2+OH-═Cl-+ClO-+H2O |
17.利用下列实验装置完成相应的实验,能达到实验目的是( )
| A. | 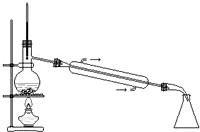 实验室中制取少量蒸馏水 | B. | 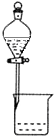 分离碘和酒精 | ||
| C. | 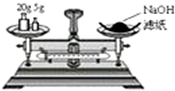 称量氢氧化钠固体 | D. | 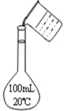 配制100 mL 0.10 mol•L-1盐酸 |
7.水银法电解食盐水是氯碱工业发展进程中的重要里程碑,以制得碱液纯度高、质量好而著称,其生产原理示意图如下.下列说法不正确的是( )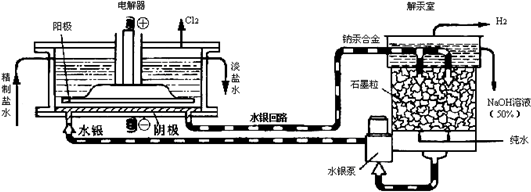

| A. | 电解器中阳极的电极反应式为:2Cl--2e-=Cl2↑ | |
| B. | 解汞室中产生氢气的电极为阴极 | |
| C. | 当阳极产生3.36 L(标准状况)气体时,解汞室中生成NaOH的质量为12 g | |
| D. | 在直流电作用下,电解器中的Na+变成金属钠,与水银形成钠汞合金,从而与Cl2分开 |
14.某海域海水一些化学成分如表所示,已知:25℃时,
Ksp(CaCO3)=2.8×10-9、Ksp(MgCO3)=6.8×10-6,
Ksp[Mg(OH)2]=1.8×10-11.
某化学小组同学欲在实验制备MgCl2,并提取Zn.设计流程如下: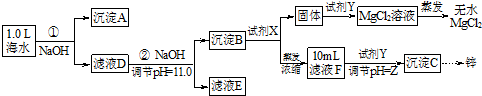
[假设①②过程溶液体积不变,忽略分离过程的损失]
(1)25℃时测得海水的pH> 7.0(填“>”、“<”、“﹦”),其原因是(写离子方程式)HCO3-+H2O?H2CO3+OH-.
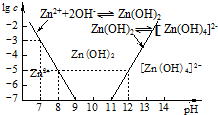
(2)如图为溶液pH与对应的Zn2+、[Zn(OH)4]2-物质的量浓度的对数坐标图.请结合图中数据回答:试剂Y的化学式为HCl;由滤液F到沉淀C过程(一般认为离子浓度低于10-5mol/L就是沉淀完全),则调节的pH范围为8<pH<12.
(3)同学们发现,把MgCl2溶液蒸干、灼烧所得的白色固体难溶于水,你认为其主要成分是MgO.原因是(用化学方程式表示)MgCl2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2HCl↑、Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O.
(4)由图中c(Zn2+)计算Zn(OH)2的溶度积Ksp=10-17.
Ksp(CaCO3)=2.8×10-9、Ksp(MgCO3)=6.8×10-6,
Ksp[Mg(OH)2]=1.8×10-11.
| 海水成分 | Na+ | Ca2+ | Mg2+ | HCO3- | Zn2+ |
| 含量/mol•L-1 | 0.4 | 0.002 | 0.045 | 0.002 | 10-7 |

[假设①②过程溶液体积不变,忽略分离过程的损失]
(1)25℃时测得海水的pH> 7.0(填“>”、“<”、“﹦”),其原因是(写离子方程式)HCO3-+H2O?H2CO3+OH-.
(2)如图为溶液pH与对应的Zn2+、[Zn(OH)4]2-物质的量浓度的对数坐标图.请结合图中数据回答:试剂Y的化学式为HCl;由滤液F到沉淀C过程(一般认为离子浓度低于10-5mol/L就是沉淀完全),则调节的pH范围为8<pH<12.

(3)同学们发现,把MgCl2溶液蒸干、灼烧所得的白色固体难溶于水,你认为其主要成分是MgO.原因是(用化学方程式表示)MgCl2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2HCl↑、Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O.
(4)由图中c(Zn2+)计算Zn(OH)2的溶度积Ksp=10-17.
12.将38.4gCu与含有2mol HNO3的浓硝酸反应至铜完全溶解后,再向溶液中加人铜时,发现铜不再溶解.则在铜完全溶解时所放出的气体体积(标准状况下)为( )
| A. | 17.92L | B. | 22.4L | C. | 8.96L | D. | 11.2L |
