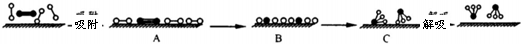题目内容
3.下列反应的离子方程式书写正确的是( )| A. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| B. | 氯气通入澄清石灰水中:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO${\;}_{3}^{2-}$+2HClO | |
| D. | 等体积、等物质的量浓度AlCl3与NaOH溶液混合:Al3++4OH-═AlO2-+H2O |
分析 A.发生氧化还原法反应,生成硝酸铁、S、NO和水;
B.反应生成氯化钙、次氯酸钙和水;
C.发生氧化还原反应生成硫酸钠;
D.等体积、等物质的量浓度,物质的量相同,碱不足,生成氢氧化铝沉淀.
解答 解:A.用稀HNO3溶解FeS固体的离子反应为NO3-+FeS+4H+═Fe3++2H2O+NO↑+S,故A错误;
B.氯气通入澄清石灰水中的离子反应为Cl2+2OH-═Cl-+ClO-+H2O,故B正确;
C.SO2气体通入NaClO溶液中的离子反应为SO2+ClO-+H2O═SO42-+Cl-+2H+,故C错误;
D.等体积、等物质的量浓度AlCl3与NaOH溶液混合的离子反应为Al3++3OH-═Al(OH)3↓,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应及氧化还原反应的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
13.下列离子方程式书写正确的是( )
| A. | 向氯化钙溶液中通入CO2:Ca2++H2O+CO2═CaCO3↓+2H+ | |
| B. | 稀硫酸与氧化铜反应:O2-+2H+═H2O | |
| C. | 碳酸钡与盐酸反应:BaCO3+2H+═Ba2++CO2↑+H2O | |
| D. | 将氯气通入碱溶液中:Cl2+OH-═Cl-+ClO-+H2O |
14.某海域海水一些化学成分如表所示,已知:25℃时,
Ksp(CaCO3)=2.8×10-9、Ksp(MgCO3)=6.8×10-6,
Ksp[Mg(OH)2]=1.8×10-11.
某化学小组同学欲在实验制备MgCl2,并提取Zn.设计流程如下: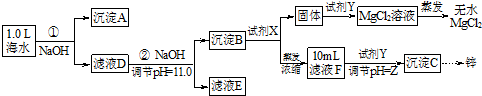
[假设①②过程溶液体积不变,忽略分离过程的损失]
(1)25℃时测得海水的pH> 7.0(填“>”、“<”、“﹦”),其原因是(写离子方程式)HCO3-+H2O?H2CO3+OH-.
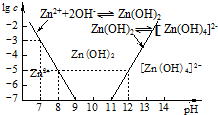
(2)如图为溶液pH与对应的Zn2+、[Zn(OH)4]2-物质的量浓度的对数坐标图.请结合图中数据回答:试剂Y的化学式为HCl;由滤液F到沉淀C过程(一般认为离子浓度低于10-5mol/L就是沉淀完全),则调节的pH范围为8<pH<12.
(3)同学们发现,把MgCl2溶液蒸干、灼烧所得的白色固体难溶于水,你认为其主要成分是MgO.原因是(用化学方程式表示)MgCl2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2HCl↑、Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O.
(4)由图中c(Zn2+)计算Zn(OH)2的溶度积Ksp=10-17.
Ksp(CaCO3)=2.8×10-9、Ksp(MgCO3)=6.8×10-6,
Ksp[Mg(OH)2]=1.8×10-11.
| 海水成分 | Na+ | Ca2+ | Mg2+ | HCO3- | Zn2+ |
| 含量/mol•L-1 | 0.4 | 0.002 | 0.045 | 0.002 | 10-7 |

[假设①②过程溶液体积不变,忽略分离过程的损失]
(1)25℃时测得海水的pH> 7.0(填“>”、“<”、“﹦”),其原因是(写离子方程式)HCO3-+H2O?H2CO3+OH-.
(2)如图为溶液pH与对应的Zn2+、[Zn(OH)4]2-物质的量浓度的对数坐标图.请结合图中数据回答:试剂Y的化学式为HCl;由滤液F到沉淀C过程(一般认为离子浓度低于10-5mol/L就是沉淀完全),则调节的pH范围为8<pH<12.

(3)同学们发现,把MgCl2溶液蒸干、灼烧所得的白色固体难溶于水,你认为其主要成分是MgO.原因是(用化学方程式表示)MgCl2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2HCl↑、Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O.
(4)由图中c(Zn2+)计算Zn(OH)2的溶度积Ksp=10-17.
18.设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A. | 标准状况下,11.2LHF中含有H-F键的数目为0.5NA | |
| B. | 常温下,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| C. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| D. | 电解饱和食盐水,阳极产生22.4L气体时,电路中通过的电子数目为2NA |
15.青蒿素对治疗疟疾有很好的效果,下列说法正确的是( )


| A. | 青蒿素易溶于水和酒精 | |
| B. | 青蒿素中含多个环状结构,其中有一个六元碳环 | |
| C. | 青蒿素中含过氧键,过氧键属于极性共价键 | |
| D. | 青蒿素和纤维素都属于高分子化合物 |
12.将38.4gCu与含有2mol HNO3的浓硝酸反应至铜完全溶解后,再向溶液中加人铜时,发现铜不再溶解.则在铜完全溶解时所放出的气体体积(标准状况下)为( )
| A. | 17.92L | B. | 22.4L | C. | 8.96L | D. | 11.2L |
6.已知32g X与40g Y恰好完全反应,生成m g Q和9g H,在相同条件下,16g X和足量Y混合生成0.25mol Q和若干摩的H,则物质Q的摩尔质量应是( )
| A. | 122 g•mol-1 | B. | 63 g•mol-1 | C. | 126 g•mol-1 | D. | 163 g•mol-1 |
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示: