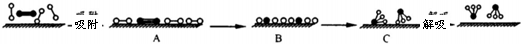题目内容
19.工业废弃物对环境的危害极大,硫酸工业废渣废弃物的主要成分为MgO、Al2O3、Fe2O3、SiO2.某同学设计以下方案,变废为宝提取废渣中的金属元素.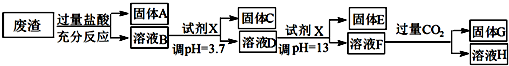
已知常温条件下:
①阳离子以氢氧化物形式完全沉淀(阳离子浓度低于10?5mol•L-1)时溶液的pH:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| pH | 3.4 | 5.2 | 11 |
请回答:
(1)写出A与氢氟酸反应的化学方程式:SiO2+4HF=SiF4↑+2H2O.
(2)上述流程中两次使用试剂X,推测试剂X是氢氧化钠(填“氨水”或“氢氧化钠”)其理由是经过计算饱和氨水的pH=11,使用氨水不能将溶液调至pH=13,所以选择氢氧化钠调节溶液酸碱性.
(3)写出F→H的反应离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是镁离子沉淀不完全或氢氧化铝溶解不完全.
(5)固体C跟HI反应的离子方程式为:2Fe(OH)3+2I-+6H+=2Fe2++I2+6H2O.
(6)试计算Mg(OH)2的Ksp=10-11.
分析 废渣的成分为SiO2、Fe2O3、Al2O3、MgO,当加过量盐酸时,二氧化硅和盐酸不反应,所以固体A是二氧化硅,氧化铁、氧化铝、氧化镁和盐酸反应,所以溶液B的溶质是氯化镁、氯化铁、氯化铝、盐酸;向溶液B中加氢氧化钠溶液并调节溶液的PH值,结合题意溶液pH=3.7时Fe3+已经沉淀完全知,固体C是氢氧化铁;向溶液D中加入氢氧化钠溶液并调节溶液的PH值为10.8,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀,所以固体E是氢氧化镁;溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,所以G是氢氧化铝,以此解答该题.
解答 解:废渣的成分为SiO2、Fe2O3、Al2O3、MgO,当加过量盐酸时,二氧化硅和盐酸不反应,所以固体A是二氧化硅,氧化铁、氧化铝、氧化镁和盐酸反应,所以溶液B的溶质是氯化镁、氯化铁、氯化铝、盐酸;向溶液B中加氢氧化钠溶液并调节溶液的PH值,结合题意溶液pH=3.7时Fe3+已经沉淀完全知,固体C是氢氧化铁;向溶液D中加入氢氧化钠溶液并调节溶液的PH值为10.8,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀,所以固体E是氢氧化镁;溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,所以G是氢氧化铝,
(1)A是二氧化硅,与氢氟酸反应生成四氟化硅和水,反应的化学方程式为SiO2+4HF=SiF4↑+2H2O,故答案为:SiO2+4HF=SiF4↑+2H2O;
(2)向溶液B中加试剂X并调节溶液的PH值为3.7,结合题意知,溶液pH=3.7时Fe3+已经沉淀完全知,试剂X是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂X只能是强碱溶液,可为氢氧化钠溶液,且饱和氨水溶液中c(OH-)约为1×10-3mol•L-1,pH=11,使用氨水不能将溶液调至pH=13,所以选择氢氧化钠调节溶液酸碱性,
故答案为:氢氧化钠;经过计算饱和氨水的pH=11,使用氨水不能将溶液调至pH=13,所以选择氢氧化钠调节溶液酸碱性;
(3)反应a为偏铝酸钠和过量二氧化碳能反应生成氢氧化铝和碳酸氢钠,反应方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)在强碱性条件下,铝元素以偏铝酸根离子存在,镁元素以氢氧化镁存在,当溶液的PH=13时,溶液呈强碱性,如果pH过小,可能导致的后果是镁离子沉淀不完全或氢氧化铝溶解不完全等.
故答案为:镁离子沉淀不完全或氢氧化铝溶解不完全;
(5)固体C是氢氧化铁,与HI溶液发生氧化还原反应,反应的离子方程式为2Fe(OH)3+2I-+6H+=2Fe2++I2+6H2O,
故答案为:2Fe(OH)3+2I-+6H+=2Fe2++I2+6H2O;
(6)由表中数据可知氢氧化镁完全沉淀时pH=11,则Mg(OH)2的Ksp=c(Mg2+)×c2(OH)-=10-5×(10-3)2=10-11,
故答案为:10-11.
点评 本题考查了物质的分离、提纯的方法选择及应用,实验方案设计和评价,为高考常见题型,侧重于学生的分析、实验和计算能力的考查,题目难度较大,明确各物质的性质是解本题的关键,本题注意溶度积的相关计算.

 天天向上口算本系列答案
天天向上口算本系列答案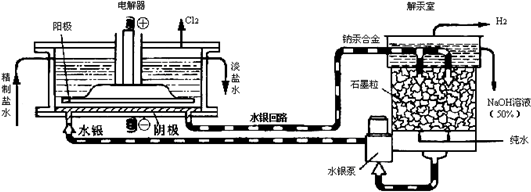
| A. | 电解器中阳极的电极反应式为:2Cl--2e-=Cl2↑ | |
| B. | 解汞室中产生氢气的电极为阴极 | |
| C. | 当阳极产生3.36 L(标准状况)气体时,解汞室中生成NaOH的质量为12 g | |
| D. | 在直流电作用下,电解器中的Na+变成金属钠,与水银形成钠汞合金,从而与Cl2分开 |
Ksp(CaCO3)=2.8×10-9、Ksp(MgCO3)=6.8×10-6,
Ksp[Mg(OH)2]=1.8×10-11.
| 海水成分 | Na+ | Ca2+ | Mg2+ | HCO3- | Zn2+ |
| 含量/mol•L-1 | 0.4 | 0.002 | 0.045 | 0.002 | 10-7 |
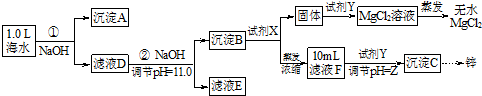
[假设①②过程溶液体积不变,忽略分离过程的损失]
(1)25℃时测得海水的pH> 7.0(填“>”、“<”、“﹦”),其原因是(写离子方程式)HCO3-+H2O?H2CO3+OH-.
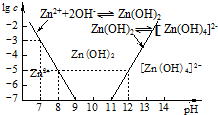
(2)如图为溶液pH与对应的Zn2+、[Zn(OH)4]2-物质的量浓度的对数坐标图.请结合图中数据回答:试剂Y的化学式为HCl;由滤液F到沉淀C过程(一般认为离子浓度低于10-5mol/L就是沉淀完全),则调节的pH范围为8<pH<12.
(3)同学们发现,把MgCl2溶液蒸干、灼烧所得的白色固体难溶于水,你认为其主要成分是MgO.原因是(用化学方程式表示)MgCl2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2HCl↑、Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O.
(4)由图中c(Zn2+)计算Zn(OH)2的溶度积Ksp=10-17.

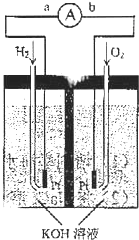 氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示: