题目内容
4.对于炔烃的描述中,不正确的是( )| A. | 分子中含有碳碳三键的不饱和链烃 | |
| B. | 易发生加成反应 | |
| C. | 既能使溴水褪色,也能使酸性高锰酸钾溶液褪色 | |
| D. | 分子里所有的碳原子都处于同一直线上 |
分析 炔烃含有C≡C键,可发生加成、氧化反应,分子中与C≡C键直接相连的原子在同一直线上,以此解答该题.
解答 解:A.炔烃含有C≡C键,为不饱和链烃,故A正确;
B.含有C≡C键,可发生加成反应,故B正确;
C.C≡C键可发生加成反应,也可被酸性高锰酸钾氧化,故C正确;
D.多碳原子的炔烃中碳原子不一定在一条直线上,如1-丁炔中的4个碳原子不在同一直线上,故D错误.
故选D.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的结构和性质的异同,把握有机物的结构特点,难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
14.某海域海水一些化学成分如表所示,已知:25℃时,
Ksp(CaCO3)=2.8×10-9、Ksp(MgCO3)=6.8×10-6,
Ksp[Mg(OH)2]=1.8×10-11.
某化学小组同学欲在实验制备MgCl2,并提取Zn.设计流程如下: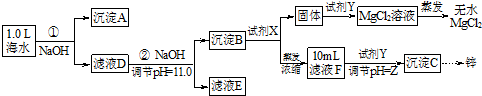
[假设①②过程溶液体积不变,忽略分离过程的损失]
(1)25℃时测得海水的pH> 7.0(填“>”、“<”、“﹦”),其原因是(写离子方程式)HCO3-+H2O?H2CO3+OH-.
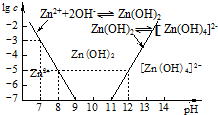
(2)如图为溶液pH与对应的Zn2+、[Zn(OH)4]2-物质的量浓度的对数坐标图.请结合图中数据回答:试剂Y的化学式为HCl;由滤液F到沉淀C过程(一般认为离子浓度低于10-5mol/L就是沉淀完全),则调节的pH范围为8<pH<12.
(3)同学们发现,把MgCl2溶液蒸干、灼烧所得的白色固体难溶于水,你认为其主要成分是MgO.原因是(用化学方程式表示)MgCl2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2HCl↑、Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O.
(4)由图中c(Zn2+)计算Zn(OH)2的溶度积Ksp=10-17.
Ksp(CaCO3)=2.8×10-9、Ksp(MgCO3)=6.8×10-6,
Ksp[Mg(OH)2]=1.8×10-11.
| 海水成分 | Na+ | Ca2+ | Mg2+ | HCO3- | Zn2+ |
| 含量/mol•L-1 | 0.4 | 0.002 | 0.045 | 0.002 | 10-7 |

[假设①②过程溶液体积不变,忽略分离过程的损失]
(1)25℃时测得海水的pH> 7.0(填“>”、“<”、“﹦”),其原因是(写离子方程式)HCO3-+H2O?H2CO3+OH-.
(2)如图为溶液pH与对应的Zn2+、[Zn(OH)4]2-物质的量浓度的对数坐标图.请结合图中数据回答:试剂Y的化学式为HCl;由滤液F到沉淀C过程(一般认为离子浓度低于10-5mol/L就是沉淀完全),则调节的pH范围为8<pH<12.

(3)同学们发现,把MgCl2溶液蒸干、灼烧所得的白色固体难溶于水,你认为其主要成分是MgO.原因是(用化学方程式表示)MgCl2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2HCl↑、Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O.
(4)由图中c(Zn2+)计算Zn(OH)2的溶度积Ksp=10-17.
15.青蒿素对治疗疟疾有很好的效果,下列说法正确的是( )


| A. | 青蒿素易溶于水和酒精 | |
| B. | 青蒿素中含多个环状结构,其中有一个六元碳环 | |
| C. | 青蒿素中含过氧键,过氧键属于极性共价键 | |
| D. | 青蒿素和纤维素都属于高分子化合物 |
12.将38.4gCu与含有2mol HNO3的浓硝酸反应至铜完全溶解后,再向溶液中加人铜时,发现铜不再溶解.则在铜完全溶解时所放出的气体体积(标准状况下)为( )
| A. | 17.92L | B. | 22.4L | C. | 8.96L | D. | 11.2L |
19.下列反应的离子方程式正确的是( )
| A. | 向Ba(0H)2溶液中滴H2SO4溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 明矾溶液中加氢氧化钡溶液,使其产生沉淀的物质的量达最大值:Al3++2SO42-+2Ba+4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | Mg(HCO3)2溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+MgCO3↓ | |
| D. | 向100mL0.1mol/L的FeBr2溶液中通入0.012molCl2:10Fe2++14Br-+12Cl2═10Fe3++7Br2+24Cl- |
9.下列事实不能说明醋酸属于弱电解质的是( )
| A. | 0.1mol/L CH3COONa溶液显碱性 | |
| B. | 0.1mol/L醋酸溶液的pH=3 | |
| C. | 物质的量浓度相同的盐酸和醋酸同时与锌反应,开始时锌粒跟盐酸反应比跟醋酸反应的速率快 | |
| D. | 中和100mL1mol/L 的CH3COOH溶液需要100mL1mol/L的NaOH溶液 |
6.已知32g X与40g Y恰好完全反应,生成m g Q和9g H,在相同条件下,16g X和足量Y混合生成0.25mol Q和若干摩的H,则物质Q的摩尔质量应是( )
| A. | 122 g•mol-1 | B. | 63 g•mol-1 | C. | 126 g•mol-1 | D. | 163 g•mol-1 |
7.二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如图1:
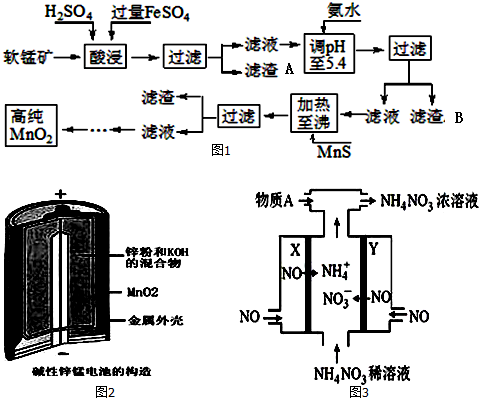
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH如表,回答下列问题
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为MnO2+2FeSO4+2H2SO4═MnSO4+Fe2(SO4)3+2H2O.
(2)滤渣A的主要成分是SiO2;滤渣B的主要成分是Fe(OH)3、Al(OH)3.
(3)加入MnS的目的是除去Cu2+、Zn2+杂质.可能原因是CuS、ZnS的溶解度较MnS小.
(4)碱性锌锰电池是一种一次性电池,其结构如图2所示.该电池放电过程产生MnOOH.该电池的正极反应式为MnO2+H2O+e-═MnO(OH)+OH-,电池总反应的方程式为Zn+2MnO2+2H2O═2MnOOH+ZnOH)2.
(5)利用该碱性锌锰电池电解NO制备NH4NO3,其工作原理如图3所示,X电极阴极,电解时阳极的电极反应为NO-3e-+2H2O=NO3-+4H+,使电解产物全部转化为NH4NO3,需补充物质A,A是NH3.

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH如表,回答下列问题
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(2)滤渣A的主要成分是SiO2;滤渣B的主要成分是Fe(OH)3、Al(OH)3.
(3)加入MnS的目的是除去Cu2+、Zn2+杂质.可能原因是CuS、ZnS的溶解度较MnS小.
(4)碱性锌锰电池是一种一次性电池,其结构如图2所示.该电池放电过程产生MnOOH.该电池的正极反应式为MnO2+H2O+e-═MnO(OH)+OH-,电池总反应的方程式为Zn+2MnO2+2H2O═2MnOOH+ZnOH)2.
(5)利用该碱性锌锰电池电解NO制备NH4NO3,其工作原理如图3所示,X电极阴极,电解时阳极的电极反应为NO-3e-+2H2O=NO3-+4H+,使电解产物全部转化为NH4NO3,需补充物质A,A是NH3.
