题目内容
18.下列除杂方法不正确的是( )| A. | 除去乙炔中混有的少量H2S气体:可用CuSO4溶液洗气 | |
| B. | 除去乙醛中混有的少量乙酸:可向混合物中加入足量的稀NaOH溶液,然后分液 | |
| C. | 除去苯中少量的苯酚:可向混合物中加入足量的浓溴水,过滤 | |
| D. | 除去溴苯中混有的少量液溴:可向混合物中加入足量的稀NaOH溶液,然后分液 |
分析 A.硫化氢与硫酸铜反应生成沉淀,而乙炔不反应;
B.乙酸与NaOH反应,增大与乙醛的沸点差异;
C.溴、三溴苯酚均易溶于苯;
D.溴与NaOH反应后,与溴苯分层.
解答 解:A.硫化氢与硫酸铜反应生成沉淀,而乙炔不反应,然后洗气可除杂,故A正确;
B.乙酸与NaOH反应,增大与乙醛的沸点差异,不分层,不能利用分液法分离,应选蒸馏法,故B错误;
C.溴、三溴苯酚均易溶于苯,不能除杂,应选NaOH溶液、分液,故C错误;
D.溴与NaOH反应后,与溴苯分层,然后分液可分离,故D正确;
故选BC.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意有机物性质的综合应用,题目难度不大.

练习册系列答案
相关题目
8.下列离子方程式书写正确的是( )
| A. | 向水中通入少量的氯气:Cl2+H2O=2H++Cl-+ClO- | |
| B. | Al2(SO4)3中加入过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| C. | 碳酸氢氨溶液和过量NaOH溶液反应:HCO3-+OH-=CO32-+H2O | |
| D. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑ |
9.关于如图的说法不正确的是( )
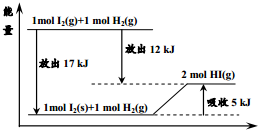

| A. | 1mol固态碘与1molH2化合生成2molHI气体时,需要吸收5kJ的能量 | |
| B. | 2molHI气体分解生成1mol碘蒸气与1molH2时需要吸收12kJ的能量 | |
| C. | 1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量 | |
| D. | 碘蒸气与H2生成HI气体的反应是吸热反应 |
6.下列设计的实验方案能达到实验目的是( )
| A. | 向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡后再加入0.5mL有机物X,加热后未出现砖红色沉淀,说明X结构中不含有醛基 | |
| B. | 室温下向苯和少量苯酚的混合溶液中加入适量浓溴水,振荡、静置后过滤,可除去苯中少量苯酚 | |
| C. | 向无色的淀粉KI溶液中滴加少量氯水,溶液变成蓝色,说明氧化性:Cl2>I2 | |
| D. | 向含酚酞的氢氧化钠溶液中加入少量30%H2O2溶液,红色褪去,向褪色后的溶液再补加NaOH溶液,不显红色,说明H2O2因显酸性而使溶液褪色 |
13.由A、B、C、D四种金属按下表中装置进行实验.
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu,溶液中Cu2+向C极移动(填“B”或“C”).
(3)当装置丙中产生3.36L(标准状况)气体时,电路中转移的电子数目为0.3NA.
(4)四种金属活动性由强到弱的顺序是D>A>B>C.
| 装置 | 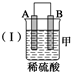 | 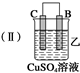 | 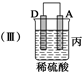 |
| 现象 | 二价金属A 不断溶解 | C的质 量增加 | A上有气 体产生 |
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu,溶液中Cu2+向C极移动(填“B”或“C”).
(3)当装置丙中产生3.36L(标准状况)气体时,电路中转移的电子数目为0.3NA.
(4)四种金属活动性由强到弱的顺序是D>A>B>C.
10.下列说法错误的是( )
| A. | 0.1 mol/L CH3COOH溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| B. | 将Al2(SO4)3溶液蒸干,灼烧得Al2O3 | |
| C. | 配制FeCl3溶液,应加少量盐酸 | |
| D. | Na2S溶液中:c(OH-)═c(H+)+c(HS-)+2c(H2S) |
7.下列叙述不正确的是( )
| A. | 离子化合物中可能存在非极性键 | |
| B. | 硫酸分子中有H+和SO42-两种离子 | |
| C. | 某原子的最外层只有一个电子,它与卤族元素可能形成离子键,也可能形成共价键 | |
| D. | 离子键和共价键的实质都是电性的相互作用 |
6.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生的反应有Zn+Cu2+=Zn2++Cu、Zn+2H+=Zn2++H2↑.(离子方程式)
(2)硫酸铜溶液可以加快氢气生成速率的原因是通过一系列反应构成了原电池,写出该原电池的电极反应式,负极:Zn-2e-=Zn2+;正极:2H++2e-=H2↑.
(3)要加快上述实验中气体产生的速率,还可采取的措施有BC.
A.将稀硫酸换成浓硫酸 B.适当升高温度
C.用锌粉代替锌粒 D.增加上述稀硫酸的用量
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(1)上述实验中发生的反应有Zn+Cu2+=Zn2++Cu、Zn+2H+=Zn2++H2↑.(离子方程式)
(2)硫酸铜溶液可以加快氢气生成速率的原因是通过一系列反应构成了原电池,写出该原电池的电极反应式,负极:Zn-2e-=Zn2+;正极:2H++2e-=H2↑.
(3)要加快上述实验中气体产生的速率,还可采取的措施有BC.
A.将稀硫酸换成浓硫酸 B.适当升高温度
C.用锌粉代替锌粒 D.增加上述稀硫酸的用量
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
 工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀,利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.
工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀,利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.