题目内容
8.下列离子方程式书写正确的是( )| A. | 向水中通入少量的氯气:Cl2+H2O=2H++Cl-+ClO- | |
| B. | Al2(SO4)3中加入过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| C. | 碳酸氢氨溶液和过量NaOH溶液反应:HCO3-+OH-=CO32-+H2O | |
| D. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑ |
分析 A.次氯酸为弱酸应保留化学式;
B.二者反应生成硫酸铵和氢氧化铝沉淀;
C.氢氧化钠过量,铵根离子、碳酸氢根离子都反应;
D.电解氯化镁溶液生成氢气、氯气和氢氧化镁,氢氧化镁为沉淀,应保留化学式;
解答 解:A.向水中通入少量的氯气,离子方程式:Cl2+H2O=H++Cl-+HClO,故A错误;
B.Al2(SO4)3中加入过量的氨水,离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B正确;
C.碳酸氢氨溶液和过量NaOH溶液反应,离子方程式:NH4++HCO3-+2OH-=CO32-+H2O+NH3•H2O,故C错误;
D.用惰性电极电解MgCl2溶液,离子方程式:Mg2++2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Mg(OH)2↓+Cl2↑+H2↑,故D错误;
故选:B.
点评 本题考查离子反应方程式书写,为高频考点,明确反应实质及离子方程式书写方法是解题关键,注意反应物用量对反应的影响,题目难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
19.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: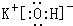 .
.
(3)最高价氧化物是两性氧化物的元素是Al;
(4)用电子式表示元素④与⑥的化合物的形成过程: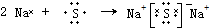 .
.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
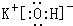 .
.(3)最高价氧化物是两性氧化物的元素是Al;
(4)用电子式表示元素④与⑥的化合物的形成过程:
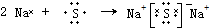 .
.
16.下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在周期表中位置相符的一组是( )
| A. |
| B. |
| C. |
| D. |
|
3.下列说法正确的是( )
| A. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| B. | 第ⅥA族元素中,气态氢化物稳定性最好的其单质氧化性也最强 | |
| C. | 同周期非金属氧化物对应水化物的酸性从左到右依次增强 | |
| D. | 第二周期元素的最高化合价为+1→+7 |
20.有机物A的分子式为C5H12O2,则符合下列条件的有机化合物A的同分异物体有(不考虑立体异构)( )
①1molA可与金属钠反应放出1mol氢气 ②含2个-CH3 ③1个碳原子上不能连接2个羟基.
①1molA可与金属钠反应放出1mol氢气 ②含2个-CH3 ③1个碳原子上不能连接2个羟基.
| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |
17.海水淡化过程中,不涉及的方法是( )
| A. | 萃取法 | B. | 电渗析法 | C. | 离子交换法 | D. | 蒸馏法 |
18.下列除杂方法不正确的是( )
| A. | 除去乙炔中混有的少量H2S气体:可用CuSO4溶液洗气 | |
| B. | 除去乙醛中混有的少量乙酸:可向混合物中加入足量的稀NaOH溶液,然后分液 | |
| C. | 除去苯中少量的苯酚:可向混合物中加入足量的浓溴水,过滤 | |
| D. | 除去溴苯中混有的少量液溴:可向混合物中加入足量的稀NaOH溶液,然后分液 |
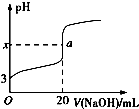 某铵态氮肥由W、X、Y、Z等四种短周期元素组成,其中W的原子半径最小.
某铵态氮肥由W、X、Y、Z等四种短周期元素组成,其中W的原子半径最小.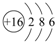 ;X和Y的原子半径N>O(填元素符号)
;X和Y的原子半径N>O(填元素符号)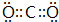 .
.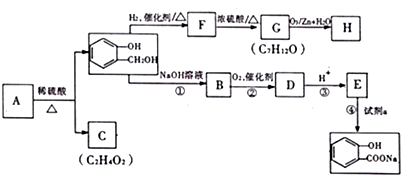
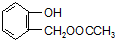 ,C含有的官能团是羧基;由F到G的反应类型为消去反应.
,C含有的官能团是羧基;由F到G的反应类型为消去反应.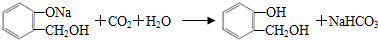 ;合适的试剂a为NaHCO3溶液.
;合适的试剂a为NaHCO3溶液.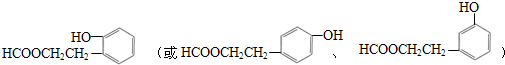 (写出一种即可).
(写出一种即可).