题目内容
9.关于如图的说法不正确的是( )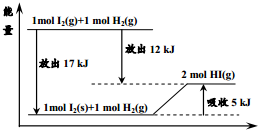
| A. | 1mol固态碘与1molH2化合生成2molHI气体时,需要吸收5kJ的能量 | |
| B. | 2molHI气体分解生成1mol碘蒸气与1molH2时需要吸收12kJ的能量 | |
| C. | 1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量 | |
| D. | 碘蒸气与H2生成HI气体的反应是吸热反应 |
分析 A.由图可知,1molI2(s)+1molH2(g)吸收5kJ热量生成2molHI(g);
B.由图可知,1molI2(g)+1molH2(g)放出12kJ热量生成2molHI(g),逆反应热量不变,放出变为吸收;
C.由图可知,1molI2(g)变为1molI2(s)放出17kJ的热量,则1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量;
D.1molI2(g)+1molH2(g)放出12kJ热量生成2molHI(g),应为放热反应.
解答 解:A.由图可知,1molI2(s)+1molH2(g)吸收5kJ热量生成2molHI(g),故A正确;
B.由图可知,1molI2(g)+1molH2(g)放出12kJ热量生成2molHI(g),则2molHI气体分解生成1mol碘蒸气与1molH2时需要吸收12kJ的能量,故B正确;
C.由图可知,1molI2(g)变为1molI2(s)放出17kJ的热量,则1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量,故C正确;
D.由图可知,1molI2(g)+1molH2(g)放出12kJ热量生成2molHI(g),应为放热反应,故D错误;
故选D.
点评 本题考查化学反应过程中的能量变化,难度不大,分析图象时要密切注意各物质的物质的量以及状态.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
19.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: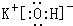 .
.
(3)最高价氧化物是两性氧化物的元素是Al;
(4)用电子式表示元素④与⑥的化合物的形成过程: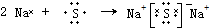 .
.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
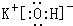 .
.(3)最高价氧化物是两性氧化物的元素是Al;
(4)用电子式表示元素④与⑥的化合物的形成过程:
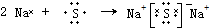 .
.
20.有机物A的分子式为C5H12O2,则符合下列条件的有机化合物A的同分异物体有(不考虑立体异构)( )
①1molA可与金属钠反应放出1mol氢气 ②含2个-CH3 ③1个碳原子上不能连接2个羟基.
①1molA可与金属钠反应放出1mol氢气 ②含2个-CH3 ③1个碳原子上不能连接2个羟基.
| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |
17.海水淡化过程中,不涉及的方法是( )
| A. | 萃取法 | B. | 电渗析法 | C. | 离子交换法 | D. | 蒸馏法 |
4.下列表示反应2A+B=C+D的速率最快的是( )
| A. | v(A)=0.5mol•L-1•s-1 | B. | v(D)=0.2mol•L-1•s-1 | ||
| C. | v(C)=0.25mol•L-1•s-1 | D. | v(B)=0.3mol•L-1•s-1 |
14.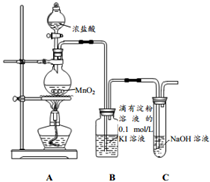 探究氯气与KI溶液的反应,某课外小组用如图装置进行实验(夹持仪器已略去,气密性已检验)
探究氯气与KI溶液的反应,某课外小组用如图装置进行实验(夹持仪器已略去,气密性已检验)
(1)装置A中生成氯气的化学反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置C中NaOH的作用是吸收多余氯气,防止污染环境;其中发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(3)能证明氯气的氧化性强于碘的实验现象是B装置中通氯气后溶液变蓝.
(4)为探究B中溶液颜色变化的原因,该小组同学查阅资料并进行实验.
查阅资料:
I2和I-在溶液中会发生反应:I2+I-?I3-,I3-显棕黄色且遇淀粉变蓝;I2可被氯气与氧化为ICl2-(红色)和ICl4-(黄色),两种离子可继续被氧化成IO3-(无色).
进行实验:
①操作Ⅰ的实验目的是证明反应后的B溶液中有淀粉,无I3-,说明溶液的浅棕色不是I3-造成的.
②写出ICl2-在水溶液中与氯气反应生成IO3-的离子方程式ICl2-+2Cl2+3H2O=IO3-+6Cl-+6H+.
③由以上实验可推断B中溶液颜色变成浅棕色的原因是I-先被氯气氧化成I2,I2又被氯气氧化成ICl2-(红色)和ICl4-(黄色),两者混合呈浅棕色溶液.
 探究氯气与KI溶液的反应,某课外小组用如图装置进行实验(夹持仪器已略去,气密性已检验)
探究氯气与KI溶液的反应,某课外小组用如图装置进行实验(夹持仪器已略去,气密性已检验)| 实验操作 | 实验现象 |
| 打开A中分液漏斗活塞,放下部分浓盐酸,加热 | 装置B中溶液变蓝色,随后蓝色褪去,溶液显浅棕色 |
(2)装置C中NaOH的作用是吸收多余氯气,防止污染环境;其中发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(3)能证明氯气的氧化性强于碘的实验现象是B装置中通氯气后溶液变蓝.
(4)为探究B中溶液颜色变化的原因,该小组同学查阅资料并进行实验.
查阅资料:
I2和I-在溶液中会发生反应:I2+I-?I3-,I3-显棕黄色且遇淀粉变蓝;I2可被氯气与氧化为ICl2-(红色)和ICl4-(黄色),两种离子可继续被氧化成IO3-(无色).
进行实验:
| 实验操作 | 实验现象 |
| Ⅰ.取反应后B中的溶液4mL分成两等份,第一份滴入1滴碘水;第二份滴入淀粉溶液 | 第一份溶液蓝色 第二份溶液颜色没有变化 |
| Ⅱ.将I2溶于KI溶液中配制得碘总浓度为0.1mol/L的溶液,取上述溶液2mL,滴加1滴淀粉溶液,再通入氯气 | 加淀粉后溶液变蓝,通氯气后蓝色褪去,溶液显浅棕色 |
| Ⅲ.向Ⅱ所得溶液继续通入氯气 | 溶液几乎变为无色 |
②写出ICl2-在水溶液中与氯气反应生成IO3-的离子方程式ICl2-+2Cl2+3H2O=IO3-+6Cl-+6H+.
③由以上实验可推断B中溶液颜色变成浅棕色的原因是I-先被氯气氧化成I2,I2又被氯气氧化成ICl2-(红色)和ICl4-(黄色),两者混合呈浅棕色溶液.
1.下列物质的每步转化在给定条件下能一步实现的是( )
| A. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| B. | 饱和食盐水$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2$\stackrel{△}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | NH3$→_{催化剂,△}^{O_{2}}$N2$\stackrel{H_{2}O+O_{2}}{→}$HNO3 |
18.下列除杂方法不正确的是( )
| A. | 除去乙炔中混有的少量H2S气体:可用CuSO4溶液洗气 | |
| B. | 除去乙醛中混有的少量乙酸:可向混合物中加入足量的稀NaOH溶液,然后分液 | |
| C. | 除去苯中少量的苯酚:可向混合物中加入足量的浓溴水,过滤 | |
| D. | 除去溴苯中混有的少量液溴:可向混合物中加入足量的稀NaOH溶液,然后分液 |
19.提出元素周期律并绘制了第一张元素周期表的化学家是( )
| A. | 戴维 | B. | 侯德榜 | C. | 门捷列夫 | D. | 道尔顿 |