题目内容
6.下列设计的实验方案能达到实验目的是( )| A. | 向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡后再加入0.5mL有机物X,加热后未出现砖红色沉淀,说明X结构中不含有醛基 | |
| B. | 室温下向苯和少量苯酚的混合溶液中加入适量浓溴水,振荡、静置后过滤,可除去苯中少量苯酚 | |
| C. | 向无色的淀粉KI溶液中滴加少量氯水,溶液变成蓝色,说明氧化性:Cl2>I2 | |
| D. | 向含酚酞的氢氧化钠溶液中加入少量30%H2O2溶液,红色褪去,向褪色后的溶液再补加NaOH溶液,不显红色,说明H2O2因显酸性而使溶液褪色 |
分析 A.用新制氢氧化铜悬浊液检验醛基时,必须是在碱性条件下;
B.苯酚和溴发生取代反应生成溴苯,溴苯、苯和溴能互溶;
C.同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性;
D.因为该反应中双氧水的量较少,混合溶液中NaOH过量,混合溶液呈碱性.
解答 解:A.用新制氢氧化铜悬浊液检验醛基时,必须是在碱性条件下,该实验中NaOH不足导致NaOH和硫酸铜混合溶液不是碱性,所以实验不成功,故A错误;
B.苯酚和溴发生取代反应生成溴苯,溴苯、苯和溴能互溶,应该用NaOH和苯酚反应生成可溶性的苯酚钠,然后分液除去苯中的苯酚,故B错误;
C.同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,根据实验现象知,氯气氧化碘离子生成碘,氧化剂是氯气、碘是氧化产物,则氧化性:Cl2>I2,故C正确;
D.因为该反应中双氧水的量较少,混合溶液中NaOH过量,混合溶液呈碱性,但溶液褪色,说明酚酞发生了反应,该实验应该体现双氧水的氧化性,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及氧化性强弱比较、除杂、官能团检验等知识点,明确实验原理、物质性质及其性质差异性是解本题关键,侧重考查学生分析判断能力,易错选项是D.

练习册系列答案
相关题目
16.下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在周期表中位置相符的一组是( )
| A. |
| B. |
| C. |
| D. |
|
17.海水淡化过程中,不涉及的方法是( )
| A. | 萃取法 | B. | 电渗析法 | C. | 离子交换法 | D. | 蒸馏法 |
14.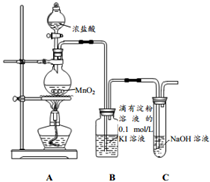 探究氯气与KI溶液的反应,某课外小组用如图装置进行实验(夹持仪器已略去,气密性已检验)
探究氯气与KI溶液的反应,某课外小组用如图装置进行实验(夹持仪器已略去,气密性已检验)
(1)装置A中生成氯气的化学反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置C中NaOH的作用是吸收多余氯气,防止污染环境;其中发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(3)能证明氯气的氧化性强于碘的实验现象是B装置中通氯气后溶液变蓝.
(4)为探究B中溶液颜色变化的原因,该小组同学查阅资料并进行实验.
查阅资料:
I2和I-在溶液中会发生反应:I2+I-?I3-,I3-显棕黄色且遇淀粉变蓝;I2可被氯气与氧化为ICl2-(红色)和ICl4-(黄色),两种离子可继续被氧化成IO3-(无色).
进行实验:
①操作Ⅰ的实验目的是证明反应后的B溶液中有淀粉,无I3-,说明溶液的浅棕色不是I3-造成的.
②写出ICl2-在水溶液中与氯气反应生成IO3-的离子方程式ICl2-+2Cl2+3H2O=IO3-+6Cl-+6H+.
③由以上实验可推断B中溶液颜色变成浅棕色的原因是I-先被氯气氧化成I2,I2又被氯气氧化成ICl2-(红色)和ICl4-(黄色),两者混合呈浅棕色溶液.
 探究氯气与KI溶液的反应,某课外小组用如图装置进行实验(夹持仪器已略去,气密性已检验)
探究氯气与KI溶液的反应,某课外小组用如图装置进行实验(夹持仪器已略去,气密性已检验)| 实验操作 | 实验现象 |
| 打开A中分液漏斗活塞,放下部分浓盐酸,加热 | 装置B中溶液变蓝色,随后蓝色褪去,溶液显浅棕色 |
(2)装置C中NaOH的作用是吸收多余氯气,防止污染环境;其中发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(3)能证明氯气的氧化性强于碘的实验现象是B装置中通氯气后溶液变蓝.
(4)为探究B中溶液颜色变化的原因,该小组同学查阅资料并进行实验.
查阅资料:
I2和I-在溶液中会发生反应:I2+I-?I3-,I3-显棕黄色且遇淀粉变蓝;I2可被氯气与氧化为ICl2-(红色)和ICl4-(黄色),两种离子可继续被氧化成IO3-(无色).
进行实验:
| 实验操作 | 实验现象 |
| Ⅰ.取反应后B中的溶液4mL分成两等份,第一份滴入1滴碘水;第二份滴入淀粉溶液 | 第一份溶液蓝色 第二份溶液颜色没有变化 |
| Ⅱ.将I2溶于KI溶液中配制得碘总浓度为0.1mol/L的溶液,取上述溶液2mL,滴加1滴淀粉溶液,再通入氯气 | 加淀粉后溶液变蓝,通氯气后蓝色褪去,溶液显浅棕色 |
| Ⅲ.向Ⅱ所得溶液继续通入氯气 | 溶液几乎变为无色 |
②写出ICl2-在水溶液中与氯气反应生成IO3-的离子方程式ICl2-+2Cl2+3H2O=IO3-+6Cl-+6H+.
③由以上实验可推断B中溶液颜色变成浅棕色的原因是I-先被氯气氧化成I2,I2又被氯气氧化成ICl2-(红色)和ICl4-(黄色),两者混合呈浅棕色溶液.
1.下列物质的每步转化在给定条件下能一步实现的是( )
| A. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| B. | 饱和食盐水$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2$\stackrel{△}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | NH3$→_{催化剂,△}^{O_{2}}$N2$\stackrel{H_{2}O+O_{2}}{→}$HNO3 |
18.下列除杂方法不正确的是( )
| A. | 除去乙炔中混有的少量H2S气体:可用CuSO4溶液洗气 | |
| B. | 除去乙醛中混有的少量乙酸:可向混合物中加入足量的稀NaOH溶液,然后分液 | |
| C. | 除去苯中少量的苯酚:可向混合物中加入足量的浓溴水,过滤 | |
| D. | 除去溴苯中混有的少量液溴:可向混合物中加入足量的稀NaOH溶液,然后分液 |
15.下列有关化学键的叙述,不正确的是( )
| A. | 非金属元素构成的单质中一定存在共价键 | |
| B. | 由不同种原子间形成的共价键不一定是极性键 | |
| C. | 含有共价键的化合物不一定是共价化合物 | |
| D. | 化学键断裂,不一定发生化学变化 |