题目内容
5.0.02mol•L-1的HCN溶液与0.02mol•L-1的NaCN溶液等体积混合,已知混合液中[CN-]<[Na+],则下列关系正确的是( )| A. | c(Na+)>c(CN-)>c(OH-)>c(H+) | B. | c(HCN)+(CN-)=0.04 mol•L-1 | ||
| C. | c(Na+)+c (OH-)=c(CN-)+c(H+) | D. | c(CN-)>c(HCN) |
分析 0.02mol•L-1的HCN溶液与0.02mol•L-1的NaCN溶液等体积混合,溶液中存在电荷守恒c(Na+)+c(H+)=c (OH-)+c(CN-),已知混合液中[CN-]<[Na+],则c(OH-)>c(H+),溶液呈碱性,说明HCN电离程度小于CN-水解程度,据此分析解答.
解答 解:0.02mol•L-1的HCN溶液与0.02mol•L-1的NaCN溶液等体积混合,溶液中存在电荷守恒c(Na+)+c(H+)=c (OH-)+c(CN-),已知混合液中[CN-]<[Na+],则c(OH-)>c(H+),溶液呈碱性,说明HCN电离程度小于CN-水解程度,
A.混合液中[CN-]<[Na+],结合电荷守恒得c(OH-)>c(H+),盐类水解较微弱,所以离子浓度大小顺序是c(Na+)>c(CN-)>c(OH-)>c(H+),故A正确;
B.二者等体积混合溶液体积增大一倍,溶液浓度降为原来一半,结合物料守恒得c(HCN)+(CN-)=0.02 mol•L-1,故B错误;
C.根据A知,c(Na+)>c(CN-)、c(OH-)>c(H+),所以c(Na+)+c (OH-)>c(CN-)+c(H+),故C错误;
D.溶液呈碱性,HCN电离程度小于CN-水解程度,所以c(CN-)<c(HCN),故D错误;
故选A.
点评 本题考查离子浓度大小比较,为高频考点,正确判断酸的电离程度和盐的水解程度相对大小是解本题关键,易错选项是C,很多同学往往认为是电荷守恒而导致错误.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案
相关题目
14.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是( )
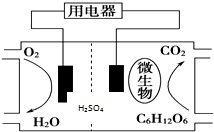

| A. | 葡萄糖在正极失去电子被氧化成CO2 | |
| B. | 微生物的作用是促进电路中电子的转移 | |
| C. | 质子通过交换膜从正极移向负极区 | |
| D. | 正极的电极反应式为O2+4H++4e-═2H2O |
16.下列变化中属于原电池反应的是( )
| A. | 白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化 | |
| B. | 在空气中金属铝表面迅速被氧化形成保护膜 | |
| C. | 红热的铁丝与水接触表面形成蓝色保护层 | |
| D. | 在铁与稀H2SO4反应时,改用铁粉,可加快H2的产生 |
20.X、Y、Z、M、R、Q是短周期主族元素,部分信息如表所示:
(1)R在元素周期表中的位置是第三周期VIIA族;R在自然界中有两种质量数不同的核素,它们之间的关系互为同位素.
(2)Z的单质与水反应的离子方程式是2Na+2H2O=2Na++2OH-+H2↑.
(3)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是bc(选填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态 b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价 d.沸点XR>YX4
(4)根据表中数据推测,Y的原子半径的最小范围是0.099nm<r(Si)<0.143nm.
(5)X、M、R形成的能够杀菌、消毒物质的结构式为H-O-Cl.
(6)甲、乙是上述部分元素的最高价氧化物的水化物,且甲+乙→丙+水.若丙的水溶液呈碱性,则丙的化学式是NaAlO2.
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(2)Z的单质与水反应的离子方程式是2Na+2H2O=2Na++2OH-+H2↑.
(3)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是bc(选填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态 b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价 d.沸点XR>YX4
(4)根据表中数据推测,Y的原子半径的最小范围是0.099nm<r(Si)<0.143nm.
(5)X、M、R形成的能够杀菌、消毒物质的结构式为H-O-Cl.
(6)甲、乙是上述部分元素的最高价氧化物的水化物,且甲+乙→丙+水.若丙的水溶液呈碱性,则丙的化学式是NaAlO2.
10. 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2 遇水易水解,并产生能使品红褪色的气体.下列说法错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2 遇水易水解,并产生能使品红褪色的气体.下列说法错误的是( )
 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2 遇水易水解,并产生能使品红褪色的气体.下列说法错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2 遇水易水解,并产生能使品红褪色的气体.下列说法错误的是( )| A. | S2Cl2与H2O反应的化学方程式可能为: 2S2Cl2+2H2O=SO2↑+3S↓+4HCl | |
| B. | S2Cl2为含有极性键和非极性键的极性分子 | |
| C. | S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 | |
| D. | S2Cl2的电子式是:Cl |
17.下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )
| A. | 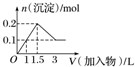 向1L浓度均为0.1 mol•L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol•L-1的稀H2SO4 | |
| B. | 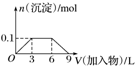 向1L浓度分别为0.1 mol•L-1和0.3 mol•L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol•L-1的稀NaOH溶液 | |
| C. | 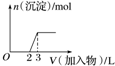 向烧碱溶液中滴加明矾溶液 | |
| D. |  向AlCl3溶液中滴加过量氨水 |
15.下列说法错误的是( )
| A. | 碳酸钠固体中含有碳酸氢钠固体,可用灼烧的方法 | |
| B. | 用酚酞溶液可以鉴别饱和食盐水和饱和纯碱溶液 | |
| C. | 25℃,碳酸氢钠在水中的溶解度比碳酸钠的大 | |
| D. | 氢氧化钠与二氧化碳的反应与量有关 |