题目内容
13.(1)实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体.理论上硫酸和硝酸的物质的量之比最佳为:3:2(2)实验上,即使铜粉、硫酸及硝酸都比较纯,制得的CuSO4•5H2O中还是可能存在杂质,除去这种杂质的实验操作称为重结晶.
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案甲:以空气为氧化剂.将铜粉反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案乙:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加少量FeSO4,即发生反应,生成硫酸铜.反应完全后,加M调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol•L-1,就认为沉淀完全)然后过滤、浓缩、结晶.
请回答下列问题:
①方案甲中,钢丝应在坩埚中反复灼烧;(填仪器名称)
方案丙:将钢丝放到一定量的稀硫酸中,加入适量的H2O2,并控制温度在50℃~60℃,持续反应1h,也能获得硫酸铜.请回答下列问题:
②反应时温度必须控制在50℃~60℃,温度不宜过高的主要原因是防止过氧化氢分解.
分析 (1)依据铜和稀硝酸反应的离子方程式,理解反应实质氢离子是硫酸和硝酸提供;
(2)溶解度不同的可溶性盐可用重结晶法分离;
(3)①固体灼烧应在坩埚内;
②过氧化氢受热易分解.
解答 解:(1)验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,依据离子反应实质,氢离子是硝酸和硫酸共同提供,氢离子分析可知最佳比为6:2,所以硫酸和硝酸物质的量之比最佳为3:2;
故答案为:3:2;
(2)混有硝酸铜杂质,需利用溶解度的不同,用重结晶的方法进行分离,
故答案为:重结晶;
(3)①以空气为氧化剂,将铜粉反复灼烧,铜粉为固体,固体灼烧应在坩埚内;
故答案为:坩埚;
②过氧化氢受热易分解,所以控制温度在50℃~60℃,温度不能太高,防止过氧化氢分解;
故答案为:防止过氧化氢分解.
点评 本题考查了制备物质的实验设计和方案探究、铜的化学性质,题目具有一定的综合性,需要扎实的基础知识,题目难度中等.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
2.下列混合物完全燃烧生成CO2的量可能与燃烧等物质的量的乙烯生成CO2的量相等的是( )
| A. | C2H6O和C3H8 | B. | CH4和C3H6 | C. | C3H6和C3H8 | D. | CH4和C2H2 |
18.下列说法中正确的是( )
| A. | 食品中大量添加苯甲酸钠等防腐剂,可以有效延长其保持期 | |
| B. | 利用丁达尔效应可区分淀粉溶液和NaCl溶液 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作饮用水消毒杀菌 | |
| D. | 石油分馏属于化学变化 |
5.0.02mol•L-1的HCN溶液与0.02mol•L-1的NaCN溶液等体积混合,已知混合液中[CN-]<[Na+],则下列关系正确的是( )
| A. | c(Na+)>c(CN-)>c(OH-)>c(H+) | B. | c(HCN)+(CN-)=0.04 mol•L-1 | ||
| C. | c(Na+)+c (OH-)=c(CN-)+c(H+) | D. | c(CN-)>c(HCN) |
3.在下列条件下,一定能大量共存的微粒组是( )
| A. | 甲基橙呈黄色的溶液中:K+、Na+、SO42-、S2O32- | |
| B. | 能与Al反应生成H2的溶液:Na+、Ba2+、NO3-、I- | |
| C. | 常温下水电离出的OH-为1×10-7mol/L的溶液中:K+、Na+、SO42-、AlO2- | |
| D. | 常温下pH=7的溶液中:NH4+、K+、CH3COO-、NO3- |
 .
.
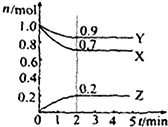 某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,图中数据分析:
某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,图中数据分析: