题目内容
17.下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )| A. | 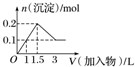 向1L浓度均为0.1 mol•L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol•L-1的稀H2SO4 | |
| B. | 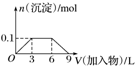 向1L浓度分别为0.1 mol•L-1和0.3 mol•L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol•L-1的稀NaOH溶液 | |
| C. | 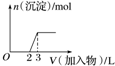 向烧碱溶液中滴加明矾溶液 | |
| D. | 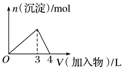 向AlCl3溶液中滴加过量氨水 |
分析 A.向Ba(OH)2、NaAlO2混合溶液中加稀H2SO4,开始生成硫酸钡沉淀和氢氧化铝沉淀,硫酸过量时氢氧化铝溶解;
B.氢氧化铝与氢氧化钠反应时,二者物质的量比为1:1;
C.铝离子与过量的氢氧根离子反应生成偏铝酸根离子,偏铝酸根离子与铝离子反应生成氢氧化铝沉淀;
D.氢氧化铝不溶于氨水.
解答 解:A.向1L浓度均为0.1 mol•L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol•L-1的稀H2SO4,0.1molBa(OH)2消耗0.1mol硫酸,0.1molNaAlO2消耗0.05mol硫酸,硫酸过量时氢氧化铝溶解,0.1mol氢氧化铝消耗硫酸0.15mol,故A正确;
B.向1L浓度分别为0.1 mol•L-1和0.3 mol•L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol•L-1的稀NaOH溶液,AlCl3与NaOH反应生成沉淀,然后氢氧化钠与氯化铵反应生成氨水,最后氢氧化铝与氢氧化钠反应,沉淀溶解,此时氢氧化铝与氢氧化钠的物质的量比为1:1,图象不符,故B错误;
C.铝离子与过量的氢氧根离子反应生成偏铝酸根离子,偏铝酸根离子与铝离子反应生成氢氧化铝沉淀,偏铝酸根离子的物质的量是铝离子的$\frac{1}{3}$,图象不符合,故C错误;
D.向AlCl3溶液中滴加过量氨水,开始产生氢氧化铝沉淀,氨水过量时,沉淀不溶解,因为氢氧化铝不溶于氨水,图象不符合,故D错误.
故选A.
点评 本题考查了混合物反应的计算与应用,题目难度中等,明确发生反应的实质为反应的先后顺序为解答关键,试题充分培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
7.根据元素周期表和元素周期律分析下面的推断,其中不正确的是( )
| A. | 氢氧化镭[Ra(OH2)]比氢氧化钙的碱性强 | |
| B. | 砹(At)的单质颜色为黑色 | |
| C. | 铍(Be)的原子失电子能力比镁弱 | |
| D. | 硒(Se)化氢比硫化氢稳定 |
5.0.02mol•L-1的HCN溶液与0.02mol•L-1的NaCN溶液等体积混合,已知混合液中[CN-]<[Na+],则下列关系正确的是( )
| A. | c(Na+)>c(CN-)>c(OH-)>c(H+) | B. | c(HCN)+(CN-)=0.04 mol•L-1 | ||
| C. | c(Na+)+c (OH-)=c(CN-)+c(H+) | D. | c(CN-)>c(HCN) |
9.下列叙述正确的是( )
| A. | 氯化钠的电离是指在电流作用下离解成钠离子和氯离子 | |
| B. | 溶于水后能电离出氢离子的化合物都是酸 | |
| C. | 硫酸钡难溶于水,所以硫酸钡属于弱电解质 | |
| D. | 醋酸溶液中存在H+、CH3COOH、CH3COO-等微粒,故醋酸是弱电解质 |
6.A、B、C三种强电解质,它们在水中电离出的离子如表所示:
如图1中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加了16g.常温下各烧杯中溶液的pH与电解时间t的关系如图2.据此回答下列问题:
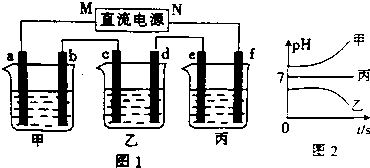
(1)电极b上发生的电极反应为4OH--4e-=2H2O+O2↑.
(2)写出乙烧杯的电解池总反应化学方程式2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4.
(3)用惰性电极电解B溶液,当阳离子浓度下降至一半时停止通电,加入下列物质不能使该溶液恢复至起始状态的是C.
A、CuO B、CuO C、Cu(OH)2 D、CuCO3
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行能(填“能”或“不能”).
(5)计算电极e上生成的气体在标准状态下的体积5.6L.
(6)要使丙烧杯溶液恢复到原来的状态,操作是向丙烧杯中加入4.5g水.
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO${\;}_{4}^{2-}$、OH- |

(1)电极b上发生的电极反应为4OH--4e-=2H2O+O2↑.
(2)写出乙烧杯的电解池总反应化学方程式2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4.
(3)用惰性电极电解B溶液,当阳离子浓度下降至一半时停止通电,加入下列物质不能使该溶液恢复至起始状态的是C.
A、CuO B、CuO C、Cu(OH)2 D、CuCO3
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行能(填“能”或“不能”).
(5)计算电极e上生成的气体在标准状态下的体积5.6L.
(6)要使丙烧杯溶液恢复到原来的状态,操作是向丙烧杯中加入4.5g水.
7.下列与实验相关的叙述正确的是( )
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 用浓硫酸配制一定物质的量浓度的硫酸溶液时,溶解后的溶液未冷却至室温就转移入容量瓶,会造成所配溶液浓度偏高 | |
| C. | 溶液加入稀盐酸产生无色气体,将气体通入澄清石灰水,变浑浊,原溶液一定含有CO32- | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |

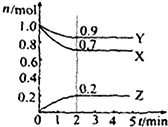 某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,图中数据分析:
某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,图中数据分析: