题目内容
6.氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙.[查阅资料]
氢化钙通常用氢气与钙加热制得.
氢化钙要密封保存,遇水反应生成氢氧化钙和氢气.
钙遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热.
标准状况下氢气的密度为0.09g/L.
[进行实验]小组同学设计的制取装置如图所示(固定装置略).
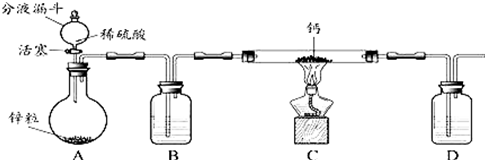
回答下列问题:
(1)写出A中发生反应的化学方程式Zn+H2SO4=ZnSO4+H2↑.
(2)B、D中所盛试剂相同,该试剂为浓硫酸,其作用分别是干燥氢气、防止空气中的水蒸汽进入C中.
(3)实验时先打开A中活塞,一段时间后,再点燃C中酒精灯,其目的是排除装置内的空气,防止加热时产生爆炸.
(4)装置C中制取氢化钙的化学方程式是H2+Ca$\frac{\underline{\;\;△\;\;}}{\;}$CaH2.
[实验反思]小组同学通过反思提出问题:上述制得的氢化钙是否纯净?
他们再次设计实验进行检验,实验步骤如下:
步骤1:检查装置气密性,装入足量的水和已称好质量的氢化钙样品,按图所示连接仪器(固定装置略).
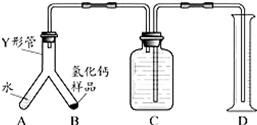
步骤2:将Y形管倾斜,使A中的水全部进入B中,完全反应后,冷却至室温,读取量筒读数.
通过上述实验可分析出制得的氢化钙是否纯净,其依据是根据实验得出的氢气的体积,可计算出氢气的质量,再根据氢化钙与水反应的化学方程式,计算出所需氢化钙的质量,并与氢化钙样品质量作对比.
分析 (1)Zn与稀硫酸反应生成硫酸锌和氢气;
(2)由实验装置可知,因Ca与水反应,则B、D中均利用浓硫酸吸收水,在C中发生Ca与氢气的反应;
(3)氢气不纯,加热易发生爆炸;
(4)Ca与氢气发生反应生成氢化钙;
【实验反思】利用氢气的质量计算氢化钙的质量,从而判断是否纯净.
解答 解:(1)实验室用稀硫酸和锌粒反应制取氢气,化学方程式Zn+H2SO4=ZnSO4+H2↑,故答案为:Zn+H2SO4=ZnSO4+H2↑;
(2)用氢气与钙加热制得氢化钙,因钙遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热,所以与钙反应的氢气必须是干燥的氢气,故制取的氢气需通过浓硫酸进行干燥,因生成的氢化钙遇水反应生成氢氧化钙和氢气,因此为防止防止空气中的水蒸汽进入C中,需在D中装有浓硫酸进行干燥,
故答案为:浓硫酸;干燥氢气;防止空气中的水蒸汽进入C中;
(3)点燃不纯的氢气可能会发生爆炸,因此氢气与钙加热反应前需将装置内的空气排出,故实验时先打开A中活塞,一段时间后,再点燃C中酒精灯,以排除装置内的空气,防止加热时产生爆炸,
故答案为:排除装置内的空气,防止加热时产生爆炸;
(4)钙和氢气反应在加热的条件下生成氢化钙,反应的方程式为H2+Ca$\frac{\underline{\;\;△\;\;}}{\;}$CaH2,故答案为:H2+Ca$\frac{\underline{\;\;△\;\;}}{\;}$CaH2;
【实验反思】根据图示,要验证氢化钙是否纯净,可取一定量氢化钙样品与水完全反应,根据生成氢气的质量求出氢化钙的质量,然后与样品质量比较,
故答案为:根据实验得出的氢气的体积,可计算出氢气的质量,再根据氢化钙与水反应的化学方程式,计算出所需氢化钙的质量,并与氢化钙样品质量作对比.
点评 本题考查物质的制备实验方案,为高频考点,把握物质的性质、发生的反应、实验装置的作用及实验技能为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度不大.

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案 A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如图所示,A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素.下列说法错误的是( )
A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如图所示,A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素.下列说法错误的是( )| A. | 氢化物的稳定性:B>D | B. | 简单离子的半径大小:D>E>C | ||
| C. | 简单阴离子的还原性:C<D | D. | A、B、C可形成离子化合物 |
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | C | O | F | |||||
| 3 | Na | Mg | P | S | Cl |
(2)CO2中存在的化学键为共价键.
(3)下列判断正确的是B
A.碱性强弱:Mg(OH)2>NaOH B.氢化物稳定性:HF>HCl
C.酸性强弱:H3PO4>H2SO4
(4)画氯离子(Cl-)的结构示意图
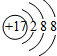 .
. | A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中: c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 已知某温度下,Ksp(AgCl)=1×10-10,Ksp(Ag2CrO4)=1×10-12.若将0.001mol•L-1AgNO3溶液滴入浓度均为0.001 mol•L-1的KCl和K2CrO4混合溶液中,则先产生Ag2CrO4沉淀 |
| A. | Y的气态氢化物的沸点在同主族中最高,所以其气态氢化物最稳定 | |
| B. | Y、W形成的化合物与Y、Z形成的化合物中所含化学键相同 | |
| C. | 简单离子半径:Z>Y | |
| D. | 单质的氧化性:Y>W |
| A. | SO3 | B. | HCl | C. | FeCl2 | D. | Na2O2 |
| A. | 将少量碳酸钠溶液滴加到盐酸中 CO32-+2H +═H2O+CO2↑ | |
| B. | 向明矾中加入氢氧化钡使硫酸根完全沉淀 Ba2++SO42-═BaSO4↓ | |
| C. | 苯酚钠中通入少量CO2 C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| D. | 向石灰乳中通入过量的SO2 OH-+SO2═HSO3- |
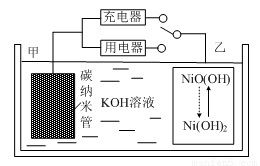
 2Ni(OH)2
2Ni(OH)2