题目内容
19.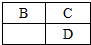 A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如图所示,A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素.下列说法错误的是( )
A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如图所示,A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素.下列说法错误的是( )| A. | 氢化物的稳定性:B>D | B. | 简单离子的半径大小:D>E>C | ||
| C. | 简单阴离子的还原性:C<D | D. | A、B、C可形成离子化合物 |
分析 A、B、C、D、E均为短周期主族元素,A是短周期中原子半径最小的元素,则A为H;E是短周期中最活泼的金属元素,则E为Na;结合B、C、D在周期表中的位置关系,设C的原子序数为x,则B的原子序数为x-1,D的原子序数为x+8,由A、B、C三种元素的原子序数之和等于D元素的原子序数,则1+x-1+x=x+8,解得x=8,即C为O,B为N,D为S,然后结合元素周期律及元素化合物知识来解答.
解答 解:A、B、C、D、E均为短周期主族元素,A是短周期中原子半径最小的元素,则A为H;E是短周期中最活泼的金属元素,则E为Na;结合B、C、D在周期表中的位置关系,设C的原子序数为x,则B的原子序数为x-1,D的原子序数为x+8,由A、B、C三种元素的原子序数之和等于D元素的原子序数,则1+x-1+x=x+8,解得x=8,即C为O,B为N,D为S,
A.非金属性N>S,氢化物的稳定性:B>D,故A正确;
B.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则简单离子的半径大小:D>C>E,故B错误;
C.非金属性O>S,则简单阴离子的还原性:C<D,故C正确;
D.A、B、C可形成离子化合物硝酸铵,故D正确;
故选B.
点评 本题考查位置、结构与性质的应用,为高频考点,把握元素的位置、原子序数关系、元素化合物等推断元素为解答的关键,侧重分析与应用能力的考查,注意短周期、原子序数等信息的应用,题目难度不大.

练习册系列答案
相关题目
10.下列推断或表述正确的是( )
| A. | 因为氯化铝是分子晶体,所以工业制备金属铝不采用电解氯化铝溶液,但工业制取金属镁可以采用电解氯化镁溶液的方法 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体c(Mg2+)增大 | |
| C. | 鸡蛋清中加入2滴1%醋酸铅溶液后会产生沉淀,因为蛋白质发生了变性 | |
| D. | 在BaSO4悬浊液中加入饱和碳酸钠溶液,过滤、洗涤得固体,再加盐酸产生气体.可证明Ksp(BaSO4)<Ksp(BaCO3) |
14.铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.实验室现有下列试剂:0.01mol/L 酸性KMnO4溶液、0.1mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水.请你协助他们探究所得溶液和气体的成分.
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有SO2、H2中的一种或两种.
【实验探究】
【问题讨论】
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,判断该方法是否正确并进行评价:不正确,若溶液中含有Fe3+,则无法检验溶液中是否含有Fe2+.
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有SO2、H2中的一种或两种.
【实验探究】
| 实验操作 | 预期现象 | 结论 | |
| 验证猜想Ⅰ | 步骤①:取少量0.01mol/L酸性KMnO4溶液,滴入所得溶液 | 溶液紫红色褪去 | 含有Fe2+(或溶液紫红色不褪去,不含Fe2+) |
| 步骤②:另取少量所得溶液,滴加KI-淀粉溶液 | 含有Fe3+ | ||
| 验证猜想Ⅱ | 将所得气体通入如图装置: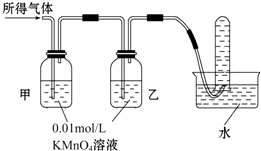 | 甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体 | 含有两种气体 |
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,判断该方法是否正确并进行评价:不正确,若溶液中含有Fe3+,则无法检验溶液中是否含有Fe2+.
4.下列有关物质用途的说法中,正确的是( )
①乙烯可用于催熟果实
②纤维素可用于造纸
③液氨可用作致冷剂
④二氧化硫可用于漂白纸浆.
①乙烯可用于催熟果实
②纤维素可用于造纸
③液氨可用作致冷剂
④二氧化硫可用于漂白纸浆.
| A. | 只有①② | B. | 只有③④ | C. | 只有②③④ | D. | ①②③④都正确 |
11.下列不能表示2mol HCl的是( )
| A. | 2 mol/L的稀盐酸1L | B. | 73g HCl | ||
| C. | 44.8 L HCl | D. | 1.204×1024个HCl分子 |
6.一定条件下,在容积为10L密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g),30s后测得生成0.04molNH3.在这段时间内H2的化学反应速率为( )
| A. | 0.0004mol/(L•min) | B. | 0.0002mol/(L•s) | C. | 0.0016 | D. | 0.012 mol/(L•min) |
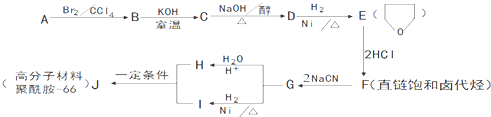
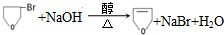 .
.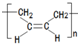 .
. .
.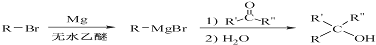
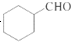 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: