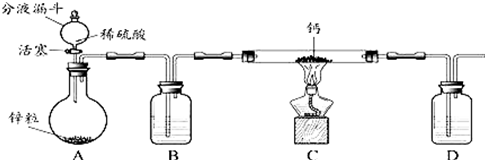
题目内容
14.下列离子方程式的书写中正确的是( )| A. | 将少量碳酸钠溶液滴加到盐酸中 CO32-+2H +═H2O+CO2↑ | |
| B. | 向明矾中加入氢氧化钡使硫酸根完全沉淀 Ba2++SO42-═BaSO4↓ | |
| C. | 苯酚钠中通入少量CO2 C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| D. | 向石灰乳中通入过量的SO2 OH-+SO2═HSO3- |
分析 A.碳酸钠与盐酸反应生成氯化钠、二氧化碳气体和水;
B.硫酸根离子恰好沉淀时,铝离子完全转化成偏铝酸根离子;
C.苯酚的酸性大于碳酸氢根离子,反应生成苯酚和碳酸氢根离子;
D.离子方程式中,石灰乳中的氢氧化钙需要保留化学式.
解答 解:A.将少量碳酸钠溶液滴加到盐酸中,反应生成二氧化碳气体,反应的离子方程式为:CO32-+2H+═H2O+CO2↑,故A正确;
B.向明矾中加入氢氧化钡使硫酸根完全沉淀,铝离子完全反应生成偏铝酸根离子,正确的离子方程式为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故B错误;
C.苯酚钠中通入少量CO2,反应生成苯酚和碳酸氢根离子,反应的离子方程式为:C6H5O-+CO2+H2O→C6H5OH+HCO3-,故C正确;
D.向石灰乳中通入过量的SO2,氢氧化钙不能拆开,正确的离子方程式为:Ca(OH)2+2SO2═2HSO3-+Ca2+,故D错误;
故选AC.
点评 本题考查了离子方程式的书写方法,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;D为易错点,注意石灰乳中的氢氧化钙不能拆开.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
2.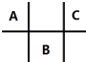 有四种短周期元素 A、B、C、D,其中 A、B、C 在周期表中所处的位置如图所示,且它们的质子数之和为 32.D 元素原子的最外层电子数为次外层电子数的2倍.则下列说法正确的是( )
有四种短周期元素 A、B、C、D,其中 A、B、C 在周期表中所处的位置如图所示,且它们的质子数之和为 32.D 元素原子的最外层电子数为次外层电子数的2倍.则下列说法正确的是( )
 有四种短周期元素 A、B、C、D,其中 A、B、C 在周期表中所处的位置如图所示,且它们的质子数之和为 32.D 元素原子的最外层电子数为次外层电子数的2倍.则下列说法正确的是( )
有四种短周期元素 A、B、C、D,其中 A、B、C 在周期表中所处的位置如图所示,且它们的质子数之和为 32.D 元素原子的最外层电子数为次外层电子数的2倍.则下列说法正确的是( )| A. | 元素D形成的气态氢化物的空间结构一定是正四面体 | |
| B. | A、B 两种元素的气态氢化物均能不它们的最高价氧化物对应的水化物发生反应,且反应类型相同 | |
| C. | DB2、DC4中每个原子都满足8电子稳定结构 | |
| D. | 四种元素形成的气态氢化物中,C元素形成的氢化物的稳定性最高 |
19.以下关于胶体的说法不正确的是( )
| A. | 胶体粒子能透过滤纸,但不能透过半透膜 | |
| B. | Fe(OH)3胶体粒子具有较大的表面积,具有吸附性,能吸附阳离子,故在电场作用下会产生电泳现象 | |
| C. | 向Fe(OH)3胶体中逐滴滴入稀硫酸,会先出现红褐色沉淀然后沉淀消失的现象 | |
| D. | 只有胶体粒子能作布朗运动 |
6.一定条件下,在容积为10L密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g),30s后测得生成0.04molNH3.在这段时间内H2的化学反应速率为( )
| A. | 0.0004mol/(L•min) | B. | 0.0002mol/(L•s) | C. | 0.0016 | D. | 0.012 mol/(L•min) |
3. 立方烷结构为立方体,其结构简式如图所示,立方烷的六氯代物有( )
立方烷结构为立方体,其结构简式如图所示,立方烷的六氯代物有( )
 立方烷结构为立方体,其结构简式如图所示,立方烷的六氯代物有( )
立方烷结构为立方体,其结构简式如图所示,立方烷的六氯代物有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
18.碳、氮广泛的分布在自然界中,碳、氮的化合物性能优良,在工业生产和科技领域有重要用途.

(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700°C的氮气流中反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g).△H=-1591.2kJ/mol,则该反应每转移1mole-,可放出的热量为132.6kJ.
(2)某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如表数据:
①实验1中,前5min的反应速率v(CO2)=0.15mol/(L.min).
②下列能判断实验2已经达到平衡状态的是ad.
a.容器内CO、H2O、CO2、H2的浓度不再变化 b.容器内压强不再变化
c.混合气体的密度保持不变 d.v正(CO)=v逆(CO2)
e.容器中气体的平均相对分子质量不随时间而变化
③若实验2的容器是绝热的密闭容器,实验测得H2O(g)的转化率H2O%随时间变化的示意图如图1所示,b点v正>v逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行.
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图如图2,写出以石墨为电极的电池工作时负极的电极反应式CH3OH-6e-+H2O=CO2+6H+,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH=1(溶液电解前后体积的变化忽略不计).

(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700°C的氮气流中反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g).△H=-1591.2kJ/mol,则该反应每转移1mole-,可放出的热量为132.6kJ.
(2)某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如表数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/mol | ||
| CO | H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 0.5 | |
②下列能判断实验2已经达到平衡状态的是ad.
a.容器内CO、H2O、CO2、H2的浓度不再变化 b.容器内压强不再变化
c.混合气体的密度保持不变 d.v正(CO)=v逆(CO2)
e.容器中气体的平均相对分子质量不随时间而变化
③若实验2的容器是绝热的密闭容器,实验测得H2O(g)的转化率H2O%随时间变化的示意图如图1所示,b点v正>v逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行.
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图如图2,写出以石墨为电极的电池工作时负极的电极反应式CH3OH-6e-+H2O=CO2+6H+,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH=1(溶液电解前后体积的变化忽略不计).
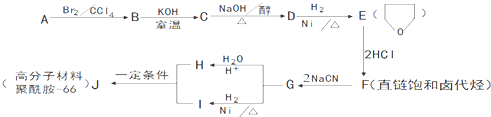
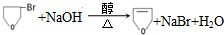 .
.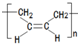 .
. .
.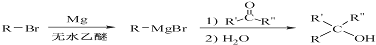
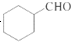 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: