题目内容
16.下表是元素周期表的一部分,根据信息,回答下列问题:| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | C | O | F | |||||
| 3 | Na | Mg | P | S | Cl |
(2)CO2中存在的化学键为共价键.
(3)下列判断正确的是B
A.碱性强弱:Mg(OH)2>NaOH B.氢化物稳定性:HF>HCl
C.酸性强弱:H3PO4>H2SO4
(4)画氯离子(Cl-)的结构示意图
 .
.
分析 (1)同周期从左向右非金属性增强,同主族从上到下非金属性减弱;第3周期第ⅣA族的元素为Si;
(2)CO2的结构式为O=C=O;
(3)A.金属性越强,对应碱的碱性越强;
B.非金属性越强,对应氢化物越稳定;
C.非金属性越强,对应最高价含氧酸的酸性越强;
(4)氯离子(Cl-)的质子数为17,核外电子为18.
解答 解:(1)同周期从左向右非金属性增强,同主族从上到下非金属性减弱,则F的非金属性最强;第3周期第ⅣA族的元素为Si,
故答案为:F;Si;
(2)CO2的结构式为O=C=O,只存在C、O之间的共价键,故答案为:共价键;
(3)A.金属性Na>Mg,对应碱的碱性为Mg(OH)2<NaOH,故A错误;
B.非金属性F>Cl,对应氢化物稳定性:HF>HCl,故B正确;
C.非金属性S>P,对应最高价含氧酸的酸性为H3PO4<H2SO4,故C错误;
故答案为:B;
(4)氯离子(Cl-)的质子数为17,核外电子为18,离子结构示意图为 ,故答案为:
,故答案为: .
.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
4.下列有关物质用途的说法中,正确的是( )
①乙烯可用于催熟果实
②纤维素可用于造纸
③液氨可用作致冷剂
④二氧化硫可用于漂白纸浆.
①乙烯可用于催熟果实
②纤维素可用于造纸
③液氨可用作致冷剂
④二氧化硫可用于漂白纸浆.
| A. | 只有①② | B. | 只有③④ | C. | 只有②③④ | D. | ①②③④都正确 |
11.下列不能表示2mol HCl的是( )
| A. | 2 mol/L的稀盐酸1L | B. | 73g HCl | ||
| C. | 44.8 L HCl | D. | 1.204×1024个HCl分子 |
2.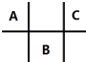 有四种短周期元素 A、B、C、D,其中 A、B、C 在周期表中所处的位置如图所示,且它们的质子数之和为 32.D 元素原子的最外层电子数为次外层电子数的2倍.则下列说法正确的是( )
有四种短周期元素 A、B、C、D,其中 A、B、C 在周期表中所处的位置如图所示,且它们的质子数之和为 32.D 元素原子的最外层电子数为次外层电子数的2倍.则下列说法正确的是( )
 有四种短周期元素 A、B、C、D,其中 A、B、C 在周期表中所处的位置如图所示,且它们的质子数之和为 32.D 元素原子的最外层电子数为次外层电子数的2倍.则下列说法正确的是( )
有四种短周期元素 A、B、C、D,其中 A、B、C 在周期表中所处的位置如图所示,且它们的质子数之和为 32.D 元素原子的最外层电子数为次外层电子数的2倍.则下列说法正确的是( )| A. | 元素D形成的气态氢化物的空间结构一定是正四面体 | |
| B. | A、B 两种元素的气态氢化物均能不它们的最高价氧化物对应的水化物发生反应,且反应类型相同 | |
| C. | DB2、DC4中每个原子都满足8电子稳定结构 | |
| D. | 四种元素形成的气态氢化物中,C元素形成的氢化物的稳定性最高 |
3. 立方烷结构为立方体,其结构简式如图所示,立方烷的六氯代物有( )
立方烷结构为立方体,其结构简式如图所示,立方烷的六氯代物有( )
 立方烷结构为立方体,其结构简式如图所示,立方烷的六氯代物有( )
立方烷结构为立方体,其结构简式如图所示,立方烷的六氯代物有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
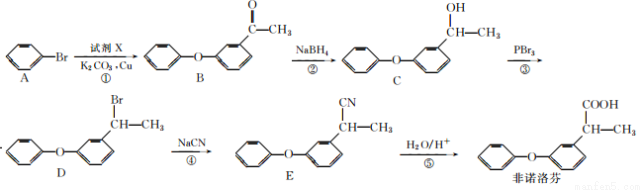
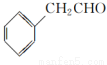 为原料制备
为原料制备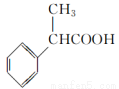 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。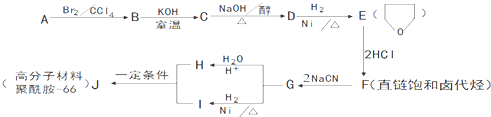
 .
.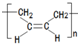 .
. .
.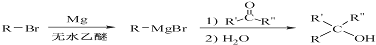
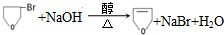
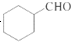 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: