题目内容
生产自来水的流程图所示.

(1)FeSO4?7H2O是常用的混凝剂,它在水中最终生成 沉淀.
(2)实验室过滤操作所用到的玻璃仪器是 .
(3)我们有时感觉自来水“有漂白粉的气味”,是因为使用了氯气消毒,请写出有关化学方程 .下列物质中 (填写序号)可以作为氯气的代用品.
①臭氧 ②NH3(溶液) ③K2FeO4 ④SO2
(4)有些地区的天然水中含有较多的钙、镁离子.用离子交换树脂软化硬水时,先后把水通过分别装有 离子交换树脂和 离子交换树脂的离子交换柱(填“阴”或“阳”).
(5)测定水中的溶解氧:量取20mL水样,迅速加入MnSO4和KOH的混合溶液,再加入KI溶液,立即塞好塞子,振荡使其完全反应.打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成.用0.10mol/L Na2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液.已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+.
上述过程发生的反应可表示为:2Mn2++4OH-+O2=2MnO(OH)2MnO(OH)2+2I-+4H+=I2+Mn2++3H2O I2+2S2O32-=2I-+S4O62-水中的溶解氧量为 (以mg?L-l为单位).

(1)FeSO4?7H2O是常用的混凝剂,它在水中最终生成
(2)实验室过滤操作所用到的玻璃仪器是
(3)我们有时感觉自来水“有漂白粉的气味”,是因为使用了氯气消毒,请写出有关化学方程
①臭氧 ②NH3(溶液) ③K2FeO4 ④SO2
(4)有些地区的天然水中含有较多的钙、镁离子.用离子交换树脂软化硬水时,先后把水通过分别装有
(5)测定水中的溶解氧:量取20mL水样,迅速加入MnSO4和KOH的混合溶液,再加入KI溶液,立即塞好塞子,振荡使其完全反应.打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成.用0.10mol/L Na2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液.已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+.
上述过程发生的反应可表示为:2Mn2++4OH-+O2=2MnO(OH)2MnO(OH)2+2I-+4H+=I2+Mn2++3H2O I2+2S2O32-=2I-+S4O62-水中的溶解氧量为
考点:物质的分离、提纯的基本方法选择与应用,氯气的化学性质,过滤、分离与注入溶液的仪器,探究物质的组成或测量物质的含量
专题:
分析:(1)亚铁离子不稳定,易被氧化生成铁离子,铁离子水解生成Fe(OH)3胶体,胶体具有吸附性而净水;
(2)过滤操作使用玻璃棒、漏斗、烧杯等仪器;
(3)氯气消毒是氯与水反应生成次氯酸消毒,强氧化性的物质可以代替氯气消毒;
(4)OH-会与钙、镁离子反应生成沉淀,影响阳离子交换树脂发挥作用;
(5)可利用关系式发生计算.
(2)过滤操作使用玻璃棒、漏斗、烧杯等仪器;
(3)氯气消毒是氯与水反应生成次氯酸消毒,强氧化性的物质可以代替氯气消毒;
(4)OH-会与钙、镁离子反应生成沉淀,影响阳离子交换树脂发挥作用;
(5)可利用关系式发生计算.
解答:
解:(1)亚铁离子不稳定,易被氧化生成铁离子,铁离子水解生成Fe(OH)3胶体,胶体具有吸附性而净水,所以FeSO4?7H2O是常用的混凝剂,它在水中最终生成Fe(OH)3沉淀,故答案为:Fe(OH)3;
(2)过滤操作使用的玻璃仪器有玻璃棒、漏斗、烧杯等;故答案为:烧杯、漏斗、玻璃棒;
(3)氯气消毒是氯与水反应生成次氯酸消毒,原理是Cl2+H2O?HCl+HClO,臭氧、K2FeO4 具有强氧化性的物质可以代替氯气消毒,故答案为:Cl2+H2O?HCl+HClO;①③;
(4)通过阴离子交换树脂后生成OH-,OH-会与钙、镁离子反应生成沉淀,影响阳离子交换树脂发挥作用,故先通过阳离子交换树脂再通过阴离子交换树脂,故答案为:阳; 阴;
(5)已知:2Mn2++4OH-+O2=2MnO(OH)2; MnO(OH)2+2I-+4H+=I2+Mn2++3H2O;I2+2S2O32-=2I-+S4O62-,可得关系式:O2~4S2O32-,n(S2O32-)=0.01mol/L×0.006L=6×10-5mol,则n(O2)=
×6×10-5mol=1.5×10-5mol,
m(O2)=1.5×10-5mol×32g/mol=48×10-5g=0.48mg,
则水中的溶解氧量为为
=24.0mg?L-1,
故答案为:24.0.
(2)过滤操作使用的玻璃仪器有玻璃棒、漏斗、烧杯等;故答案为:烧杯、漏斗、玻璃棒;
(3)氯气消毒是氯与水反应生成次氯酸消毒,原理是Cl2+H2O?HCl+HClO,臭氧、K2FeO4 具有强氧化性的物质可以代替氯气消毒,故答案为:Cl2+H2O?HCl+HClO;①③;
(4)通过阴离子交换树脂后生成OH-,OH-会与钙、镁离子反应生成沉淀,影响阳离子交换树脂发挥作用,故先通过阳离子交换树脂再通过阴离子交换树脂,故答案为:阳; 阴;
(5)已知:2Mn2++4OH-+O2=2MnO(OH)2; MnO(OH)2+2I-+4H+=I2+Mn2++3H2O;I2+2S2O32-=2I-+S4O62-,可得关系式:O2~4S2O32-,n(S2O32-)=0.01mol/L×0.006L=6×10-5mol,则n(O2)=
| 1 |
| 4 |
m(O2)=1.5×10-5mol×32g/mol=48×10-5g=0.48mg,
则水中的溶解氧量为为
| 0.48mg |
| 0.02L |
故答案为:24.0.
点评:本题考查物质的含量测定以及物质的分离、提纯实验方案的设计,题目难度中等,注意硬水的软化原理,把握关系式法的运用.

练习册系列答案
相关题目
下列关于反应能量的说法正确的是( )
| A、Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s);△H=-216kJ/mol,E反应物>E生成物 | ||||
| B、CaCO3(s)=CaO(s)+CO2(g);△H=+178.5kJ/mol,E反应物>E生成物 | ||||
C、HI(g)?
| ||||
| D、H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,含1molNaOH水溶液与含0.5mol H2SO4的浓硫酸混合后放热57.3 kJ |
下列溶液中氯离子的浓度与1L 1mol/L的AlCl3溶液中氯离子物质的量浓度相等的是( )
| A、1L 1mol/L的NaCl溶液 |
| B、1.5L 2mol/LNH4Cl溶液 |
| C、1L 1mol/L的AlCl3溶液和1mol/L的FeCl2混合溶液 |
| D、2L 1.5mol/L的CaCl2溶液 |
下列现象属于物理变化的是( )
| A、甲烷和氯气的混合气体在光照后,瓶壁上有油状液滴附着 |
| B、乙烯通入溴的四氯化碳溶液中,溶液褪色 |
| C、苯滴加到溴水中,振荡后水层接近无色 |
| D、将灼热的铜丝迅速插入乙醇中,反复多次,有刺激性气味产生 |
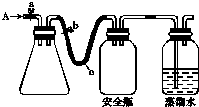 实验室用下列方法测定某水样中O2的含量.
实验室用下列方法测定某水样中O2的含量.
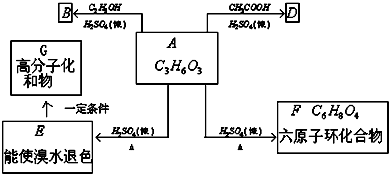
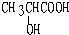 ).在浓硫酸存在下,A可发生如图所示的反应.
).在浓硫酸存在下,A可发生如图所示的反应.