题目内容
过碳酸钠(2Na2CO3?3H2O2)是一种新型高效固体漂白杀菌剂,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中.依托纯碱厂制备过碳酸钠可降低生产成本,其生产流程如图1:
请回答下列问题:
(1)反应容器中加入稳定剂的作用是 .
(2)操作①需要的玻璃仪器有 (填写仪器名称),工业采用冰水洗涤晶体的目的有 .
(3)与Cl2相比,用过碳酸钠作为漂白杀菌剂具有的优点是 .
(4)工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图2所示装置,测定工业纯碱中Na2CO3的含量.
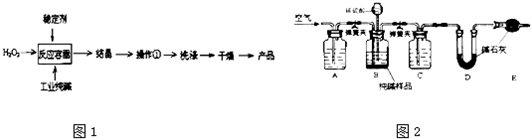
①要检验工业纯碱中杂质的存在,最好选用 试剂.
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹,往长颈漏斗中加水, ,说明装置不漏气.
③若纯碱样品的质量为m,反应前后C、D、E装置的质量分别增加ag、bg、cg,则纯碱中Na2CO3的含量为 (用含m、a、b、c的代数式表示),若缺少装置E,Na2CO3的含量将 (填“偏大”“偏小”或“不变”).
请回答下列问题:
(1)反应容器中加入稳定剂的作用是
(2)操作①需要的玻璃仪器有
(3)与Cl2相比,用过碳酸钠作为漂白杀菌剂具有的优点是
(4)工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图2所示装置,测定工业纯碱中Na2CO3的含量.

①要检验工业纯碱中杂质的存在,最好选用
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹,往长颈漏斗中加水,
③若纯碱样品的质量为m,反应前后C、D、E装置的质量分别增加ag、bg、cg,则纯碱中Na2CO3的含量为
考点:探究物质的组成或测量物质的含量
专题:
分析:(1)过碳酸钠溶于水后所得溶液,在水溶液中能解离成过氧化氢与碳酸钠,过氧化氢溶液是极弱的弱酸,而碳酸钠在水中由于水解会显示碱性,反应容器中加入稳定剂的作用是防止过氧化氢分解;
(2)操作①是过滤分离固体和溶液,过滤装置需要的玻璃仪器分析,工业采用冰水洗涤晶体的目的有洗涤去表面杂质,减少晶体损失;
(3)与Cl2相比,用过碳酸钠作为漂白杀菌剂具有的优点是无毒、环保、高效;
(4)①纯碱中常含有少量NaCl,用检验氯离子的方法进行检验,需要试剂为硝酸银和稀硝酸,
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,利用压强变化和液面变化分析判断,若漏斗中与试剂瓶中的液面差保持不再变化,证明装置气密性完好,
③若纯碱样品的质量为m,反应前后C、D、E装置的质量分别增加ag、bg、cg,利用D装置吸收的二氧化碳计算碳酸钠质量分数,依据碳元素守恒计算得到碳酸钠质量分数;若缺少装置E,空气中的二氧化碳和水蒸气被装置D吸收,称量质量增大,Na2CO3的含量将偏高;
(2)操作①是过滤分离固体和溶液,过滤装置需要的玻璃仪器分析,工业采用冰水洗涤晶体的目的有洗涤去表面杂质,减少晶体损失;
(3)与Cl2相比,用过碳酸钠作为漂白杀菌剂具有的优点是无毒、环保、高效;
(4)①纯碱中常含有少量NaCl,用检验氯离子的方法进行检验,需要试剂为硝酸银和稀硝酸,
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,利用压强变化和液面变化分析判断,若漏斗中与试剂瓶中的液面差保持不再变化,证明装置气密性完好,
③若纯碱样品的质量为m,反应前后C、D、E装置的质量分别增加ag、bg、cg,利用D装置吸收的二氧化碳计算碳酸钠质量分数,依据碳元素守恒计算得到碳酸钠质量分数;若缺少装置E,空气中的二氧化碳和水蒸气被装置D吸收,称量质量增大,Na2CO3的含量将偏高;
解答:
解:(1)过碳酸钠溶于水后所得溶液,在水溶液中能解离成过氧化氢与碳酸钠,过氧化氢溶液是极弱的弱酸,而碳酸钠在水中由于水解会显示碱性,反应容器中加入稳定剂的作用是防止过氧化氢分解;
故答案为:防止过氧化氢分解;
(2)操作①是过滤分离固体和溶液,过滤装置需要的玻璃仪器为漏斗、烧杯、玻璃棒,工业采用冰水洗涤晶体的目的有洗涤去表面杂质,减少晶体损失;
故答案为:普通漏斗、烧杯、玻璃棒;除去晶体表面的杂质并减少晶体的损失;
(3)与Cl2相比,用过碳酸钠作为漂白杀菌剂具有的优点是无毒、环保、高效;
故答案为:无毒、环保、高效;
(4)①纯碱中常含有少量NaCl,用检验氯离子的方法进行检验,需要试剂为硝酸银和稀硝酸,
故答案为:硝酸银和稀硝酸;
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,利用压强变化和液面变化分析判断,若漏斗中与试剂瓶中的液面差保持不再变化,证明装置气密性完好,
故答案为:至漏斗中液面高于洗气瓶液面,静置一段时间后,液面不下降;
③若纯碱样品的质量为m,反应前后C、D、E装置的质量分别增加ag、bg、cg,利用D装置吸收的二氧化碳计算碳酸钠质量分数,依据碳元素守恒计算得到碳酸钠质量分数=
×100%=
×100%;若缺少装置E,空气中的二氧化碳和水蒸气被装置D吸收,称量质量增大,Na2CO3的含量将偏高;
故答案为:
×100%;偏大;
故答案为:防止过氧化氢分解;
(2)操作①是过滤分离固体和溶液,过滤装置需要的玻璃仪器为漏斗、烧杯、玻璃棒,工业采用冰水洗涤晶体的目的有洗涤去表面杂质,减少晶体损失;
故答案为:普通漏斗、烧杯、玻璃棒;除去晶体表面的杂质并减少晶体的损失;
(3)与Cl2相比,用过碳酸钠作为漂白杀菌剂具有的优点是无毒、环保、高效;
故答案为:无毒、环保、高效;
(4)①纯碱中常含有少量NaCl,用检验氯离子的方法进行检验,需要试剂为硝酸银和稀硝酸,
故答案为:硝酸银和稀硝酸;
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,利用压强变化和液面变化分析判断,若漏斗中与试剂瓶中的液面差保持不再变化,证明装置气密性完好,
故答案为:至漏斗中液面高于洗气瓶液面,静置一段时间后,液面不下降;
③若纯碱样品的质量为m,反应前后C、D、E装置的质量分别增加ag、bg、cg,利用D装置吸收的二氧化碳计算碳酸钠质量分数,依据碳元素守恒计算得到碳酸钠质量分数=
| ||
| mg |
| 106b |
| 44m |
故答案为:
| 106b |
| 44m |
点评:本题考查了物质组成的实验探究方法,实验工厂分析,物质性质和离子检验,掌握实验基础和过程分析方法是解题关键,题目难度中等.

练习册系列答案
相关题目
05L 1mol/L的FeCl3与0.2L 1mol/L的KCl 溶液中,Cl-的物质的量浓度之比为( )
| A、5:2 | B、1:1 |
| C、3:1 | D、1:3 |
实验:
①向2mL 1mol?L-1 NaBr溶液中通入少量氯气,溶液变为黄色;
②取①所得溶液滴加到淀粉KI试纸上,试纸变蓝;
③向①所得溶液继续通入氯气,溶液由黄色变成橙色.
下列分析不正确的是( )
①向2mL 1mol?L-1 NaBr溶液中通入少量氯气,溶液变为黄色;
②取①所得溶液滴加到淀粉KI试纸上,试纸变蓝;
③向①所得溶液继续通入氯气,溶液由黄色变成橙色.
下列分析不正确的是( )
| A、仅根据实验①能说明还原性:Br->Cl- |
| B、仅根据实验②能说明氧化性:Br2>I2 |
| C、上述实验验证了Cl2、Br2、I2的氧化性相对强弱 |
| D、向实验③所得溶液中加CCl4,充分振荡,下层为橙红色 |
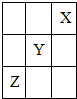 短周期元素X,Y,Z在周期表中的位置如图所示,则下列说法中错误的是( )
短周期元素X,Y,Z在周期表中的位置如图所示,则下列说法中错误的是( )| A、X,Y,Z中X的单质最稳定 |
| B、Y的氢化物为HY |
| C、Y与水反应能生成HYO |
| D、Z的最高价氧化物的水化物是强酸 |